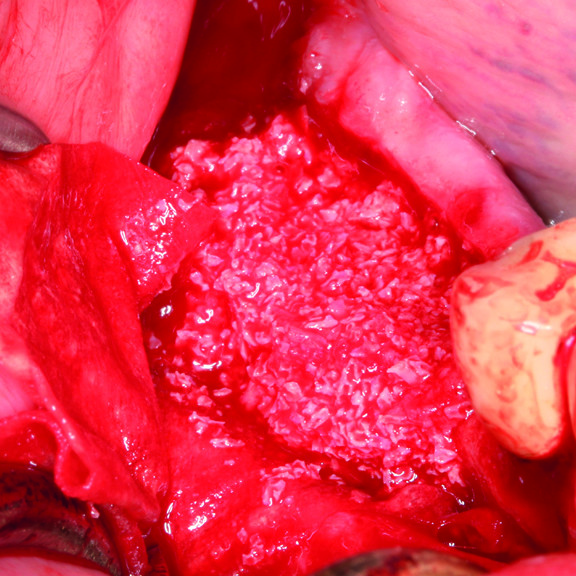
Rigenerazione dei tessuti duri
EMPOWERING REGENERATION
In REGEDENT, ci concentriamo sulla rigenerazione dei tessuti duri attraverso la sostituzione dello scaffold artificiale con cellule ossee autogene, fornendo un volume osseo stabile e riducendo al minimo il numero di interventi chirurgici. In definitiva, i pazienti beneficiano di una migliore prevedibilità del trattamento, unita a risultati a lungo termine.
CHE COS'È LA RIGENERAZIONE DEI TESSUTI DURI?
La perdita di tessuto duro/osso è un segno distintivo importante in odontoiatria. In parodontologia, ad esempio, gli agenti patogeni, i fattori genetici e gli aspetti ambientali, come il tabacco, possono portare alla perdita di tessuto duro. Ciò può comportare il movimento dei denti, la loro dislocazione e, infine, la loro perdita [1,2].
In implantologia, l'uso degli impianti dentali comporta notevoli vantaggi per i pazienti. Tuttavia, presenta alcuni rischi causati dall'utilizzo di materiali inerti a diretto contatto con l'osso e dall'assenza del legamento parodontale (PDL). Il PDL fornisce un cuscinetto per distribuire le forze masticatorie e, quando è assente, può portare al riassorbimento dell'osso mascellare [3,4].
QUATTRO TIPI DI RIGENERAZIONE DEI TESSUTI DURI
Per migliorare il processo di osteogenesi vengono utilizzate diverse tecniche, come l'innesto osseo [5], gli scaffold [6], le cellule staminali [7] e i fattori di crescita. L'innesto osseo aiuta a colmare le lacune fisiche create dall'osso mancante o danneggiato, fornisce stabilità strutturale e stimola la crescita del tessuto osseo [8]. Gli innesti ossei si dividono in quattro gruppi [9, 10]. In primo luogo, l'osso autogeno è considerato il "gold standard" per la sostituzione ossea [11], in quanto viene utilizzato con un trattamento minimo ed è il materiale sostitutivo osseo più efficiente e a più rapida guarigione [8]. Le applicazioni cliniche hanno dimostrato che si ottengono nuovo osso e nuovi annessi di tessuto connettivo parodontale [12].
In secondo luogo, le banche dei tessuti forniscono diversi tipi di innesti ossei allogenici [13]. È noto che questi innesti non sono efficaci come gli autoinnesti a causa degli estesi trattamenti chimici necessari per prevenire la potenziale infettività, che alterano la struttura gerarchica dell'osso e rimuovono una quantità significativa di fattori di crescita necessari per un'efficiente rigenerazione ossea [8].
In terzo luogo, gli xenotrapianti presentano notevoli vantaggi. Sono prodotti in massa a costi di lavorazione accessibili. Tuttavia, poiché provengono da tessuti ossei di altre specie, le loro caratteristiche osteologiche native sono diverse da quelle dei tessuti ossei umani. Tuttavia, tra gli xenotrapianti, alcuni, come i sostituti di origine suina, supportano la rigenerazione ossea grazie alle loro caratteristiche fisico-chimiche e alla loro struttura simile all'osso umano [8, 14,15]. Inoltre, l'osso suino presenta un rischio relativamente basso di zoonosi [16].
Infine, i materiali da innesto sintetici, come l'idrossiapatite, sono utilizzati per la loro osteoconduzione, durezza e accettabilità da parte dell'osso. Alcuni innesti ossei sintetici sono costituiti da carbonato di calcio, che inizia a diminuire di utilizzo perché è completamente riassorbibile in breve tempo e facilita la rottura dell'osso. Quest'ultima categoria di materiali da innesto è sempre più studiata in quanto presenta vantaggi interessanti che gli xenotrapianti non hanno.
DIECI SEGNI DI SUCCESSO DELLA RIGENERAZIONE DEI TESSUTI DURI
- Gestione semplice del materiale d'innesto e della membrana per un protocollo di trattamento economico e prevedibile.
- Utilizzo di materiale biocompatibile
- Stabilizzazione rapida dei coaguli di sangue
- Angiogenesi rapida
- Riduzione al minimo del processo infiammatorio (gonfiore, fastidio)
- Guarigione regolare della ferita
- Densità ossea prevedibile
- Volume stabile per un posizionamento prevedibile dell'impianto
- Materiale riassorbibile per evitare ulteriori interventi chirurgici e per essere sostituito da cellule autogene.
- Soddisfazione dei pazienti e dei medici
LA NOSTRA SOLUZIONE PER LA RIGENERAZIONE DEI TESSUTI DURI
Hyadent BG, Smartbrane, e Smartgraft sono stati progettati per favorire la rigenerazione dei tessuti duri e per essere ancora più facili da usare insieme.
In effetti, il gel combinato con l'osso poroso crea uno sticky bone in ~3 minuti, e la resistenza alla trazione della membrana trattiene bene il sito aumentato adattandosi facilmente alla superficie ossea, senza tuttavia incollarsi. [20] L'acido ialuronico presente nel sito aumentato sembra accelerare la formazione dell'osso grazie alle sue proprietà migratorie e proliferative. [21-24]
LE SINERGIE TRA I NOSTRI PRODOTTI RIGENERATIVI
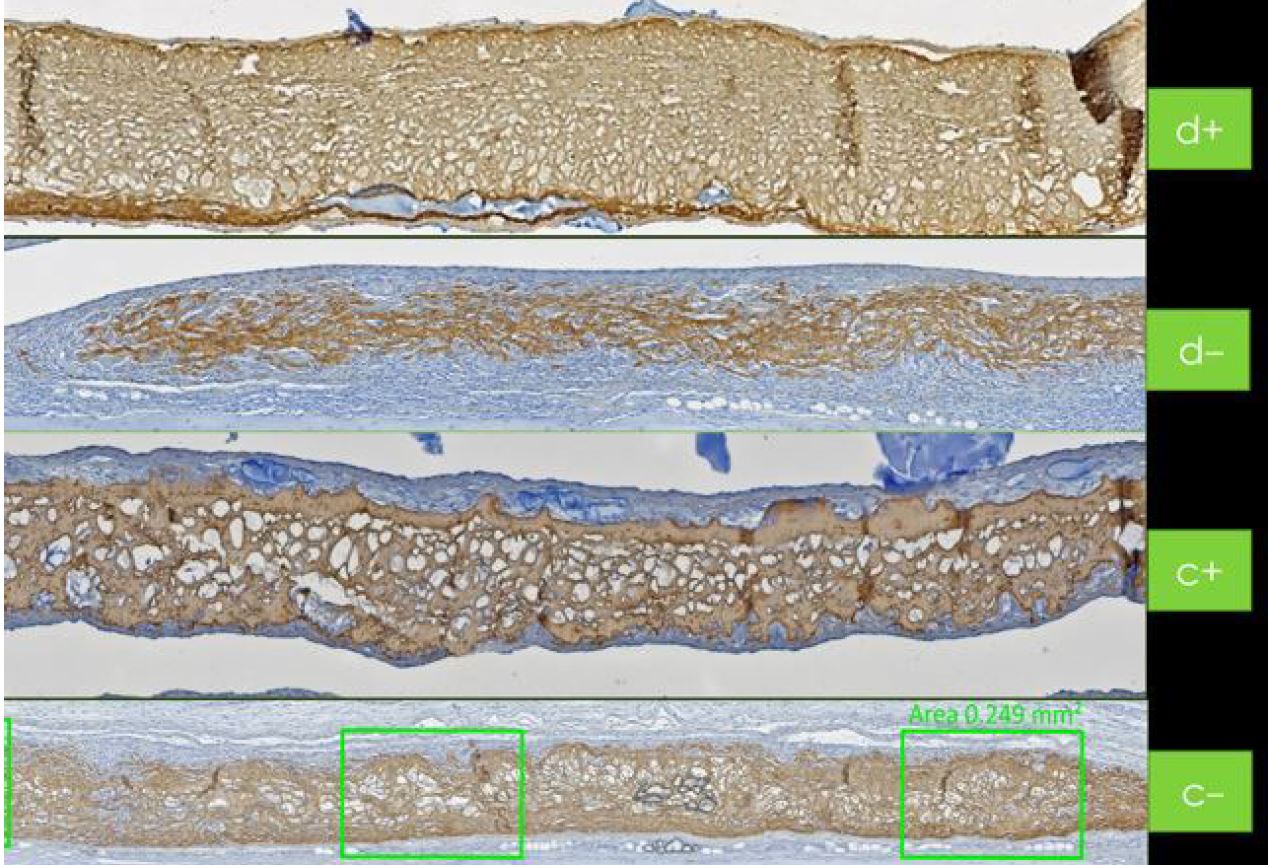
Il portfolio di Regedent supporta la rigenerazione dei tessuti duri. Hyadent BG e Smartbrane contribuiscono a stabilizzare il coagulo di sangue [25-26]. L'acido ialuronico attira i fattori di crescita naturalmente presenti nel sangue e promuove la vascolarizzazione con il supporto, ad esempio, di sostituti ossei porcini [27-29].
L'adesione e la proliferazione delle cellule ossee sono quindi facilitate dalle superfici ruvide della membrana porcina e del sostituto osseo [26, 28-31]. Allo stesso tempo, l'acido ialuronico reticolato ad alto peso molecolare aumenta la proliferazione cellulare complessiva [32-35]. Hyadent BG e Smartgraft contribuiscono ad accelerare la guarigione ossea, mostrando un rimodellamento equilibrato del volume osseo [26, 36-41].
Durante il processo di guarigione ossea, lo sticky bone con Hyadent BG e Smartgraft beneficia del suo scudo batteriostatico naturale [42]. La robusta membrana di collagene tiene insieme il sito innestato durante il processo di guarigione. La sua funzione di mantenimento è addirittura prolungata dalla collagenasi rallentata grazie al precedente rivestimento della membrana con Hyadent BG [43].
Ricostruendo non solo la struttura estetica ma anche quella funzionale intorno al dente/impianto, si ritiene che Hyadent BG rigeneri piuttosto che riparare [44-47].
Le proprietà di guarigione offerte dal portolio prodotti Regedent sono descritte in dettaglio in rigenerazione dei tessuti molli.
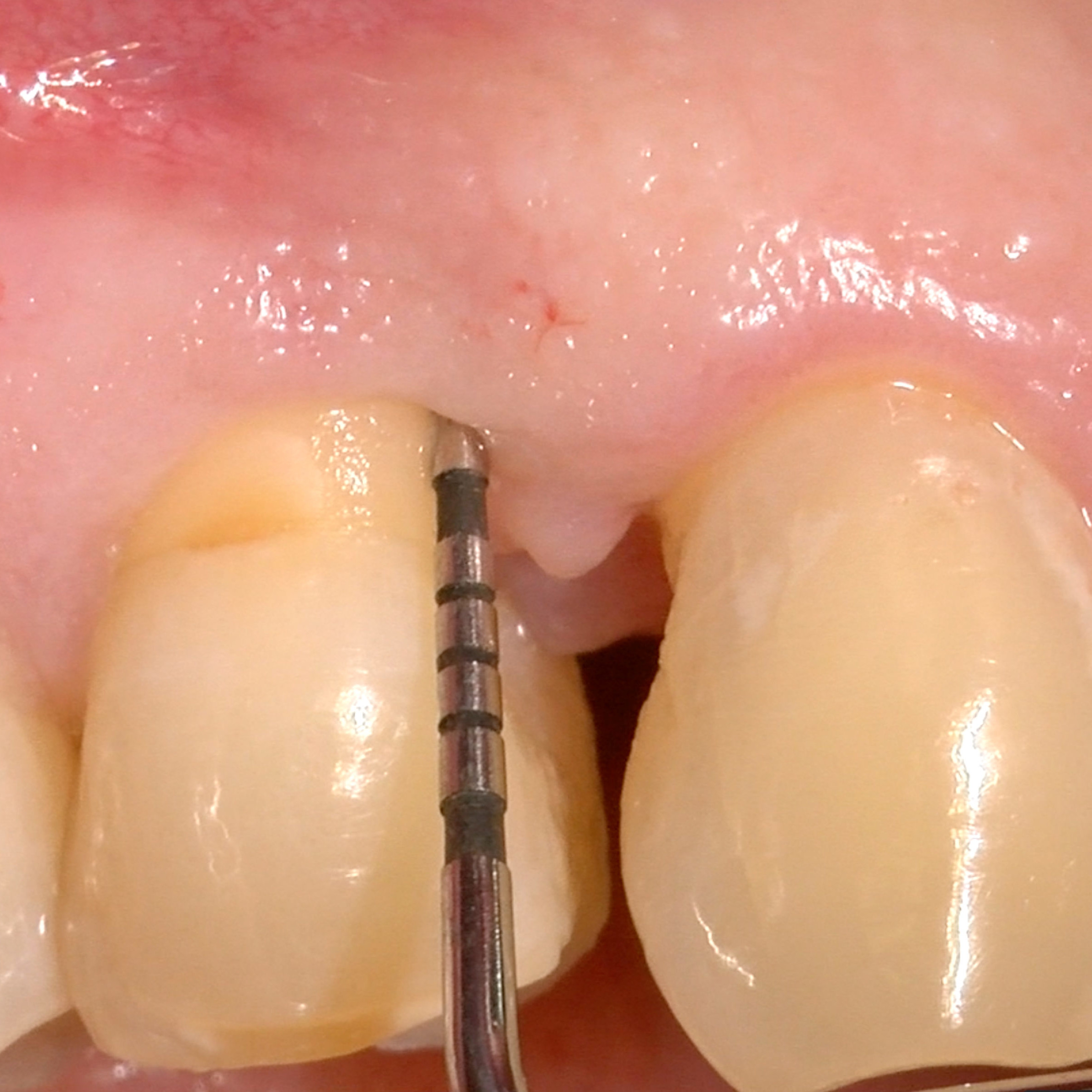
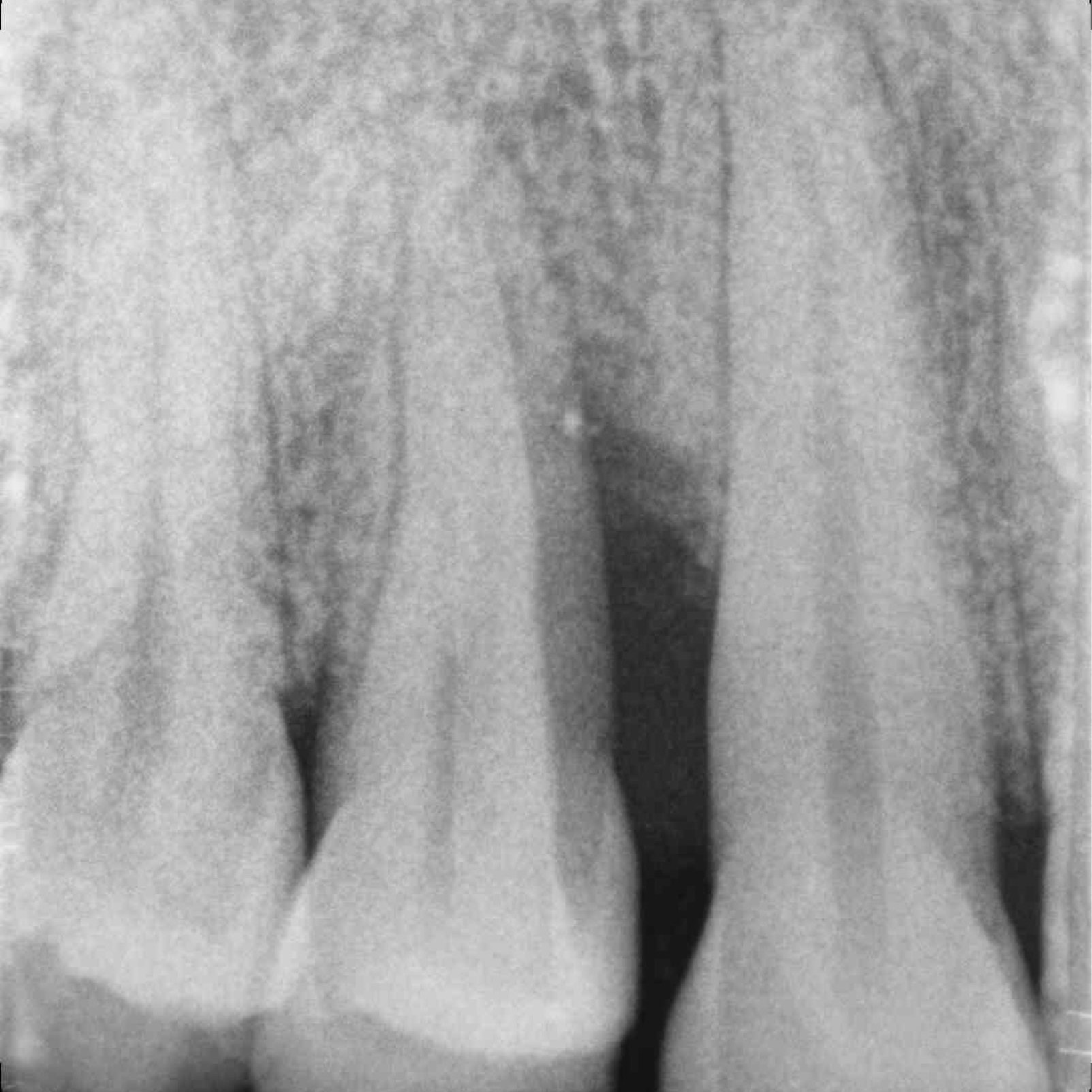
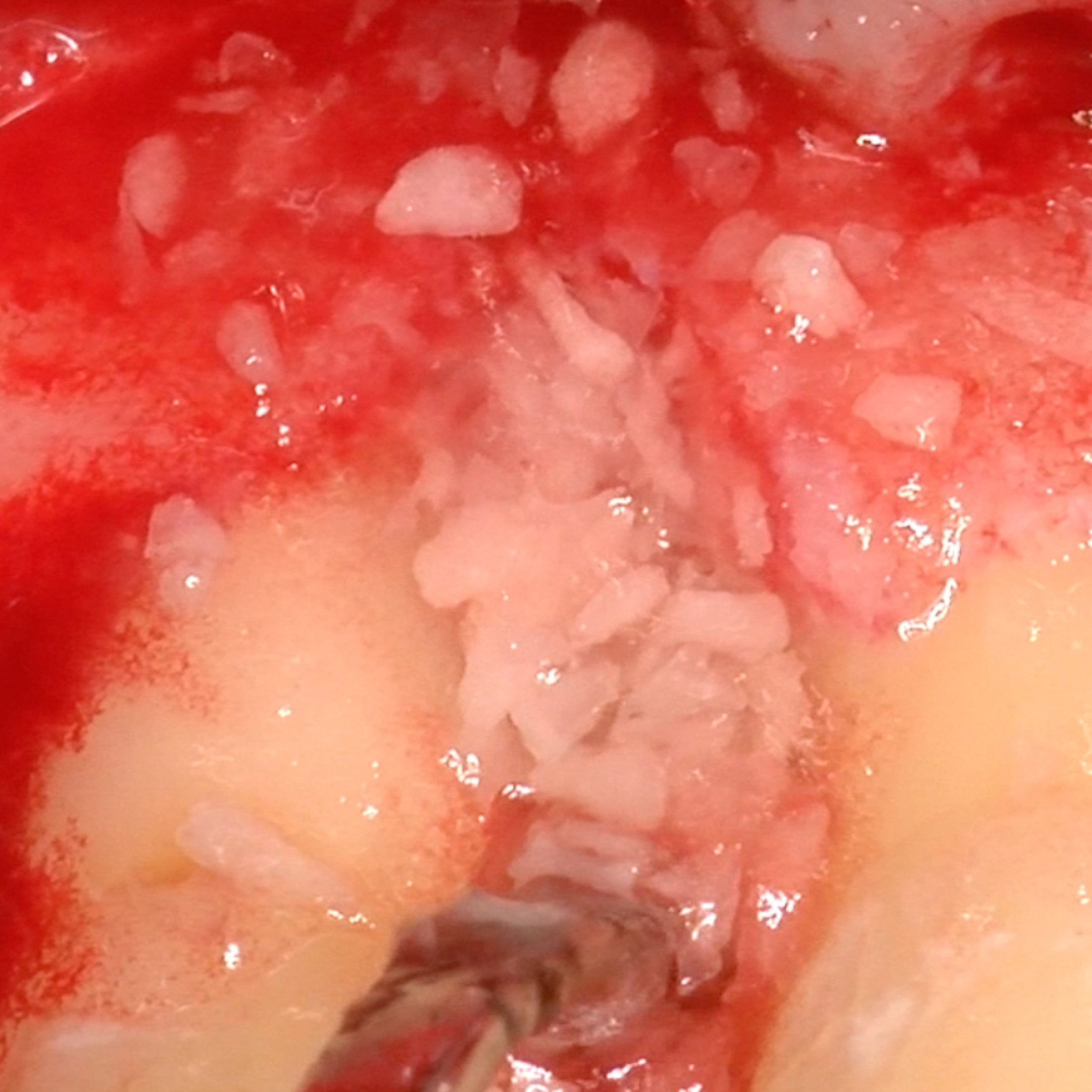
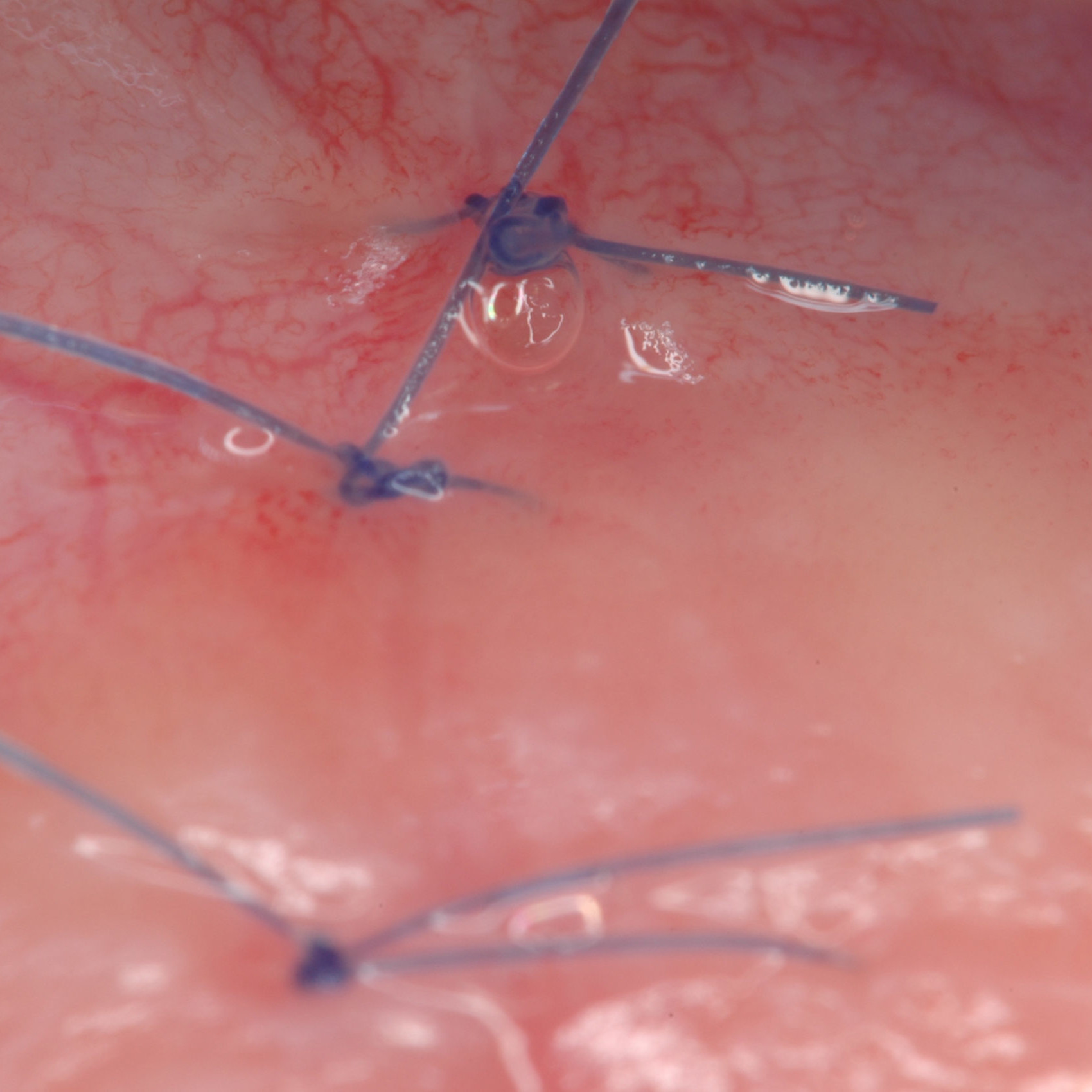
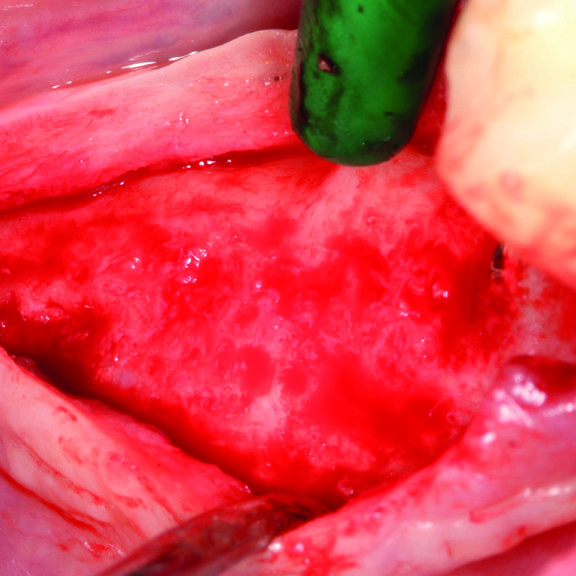
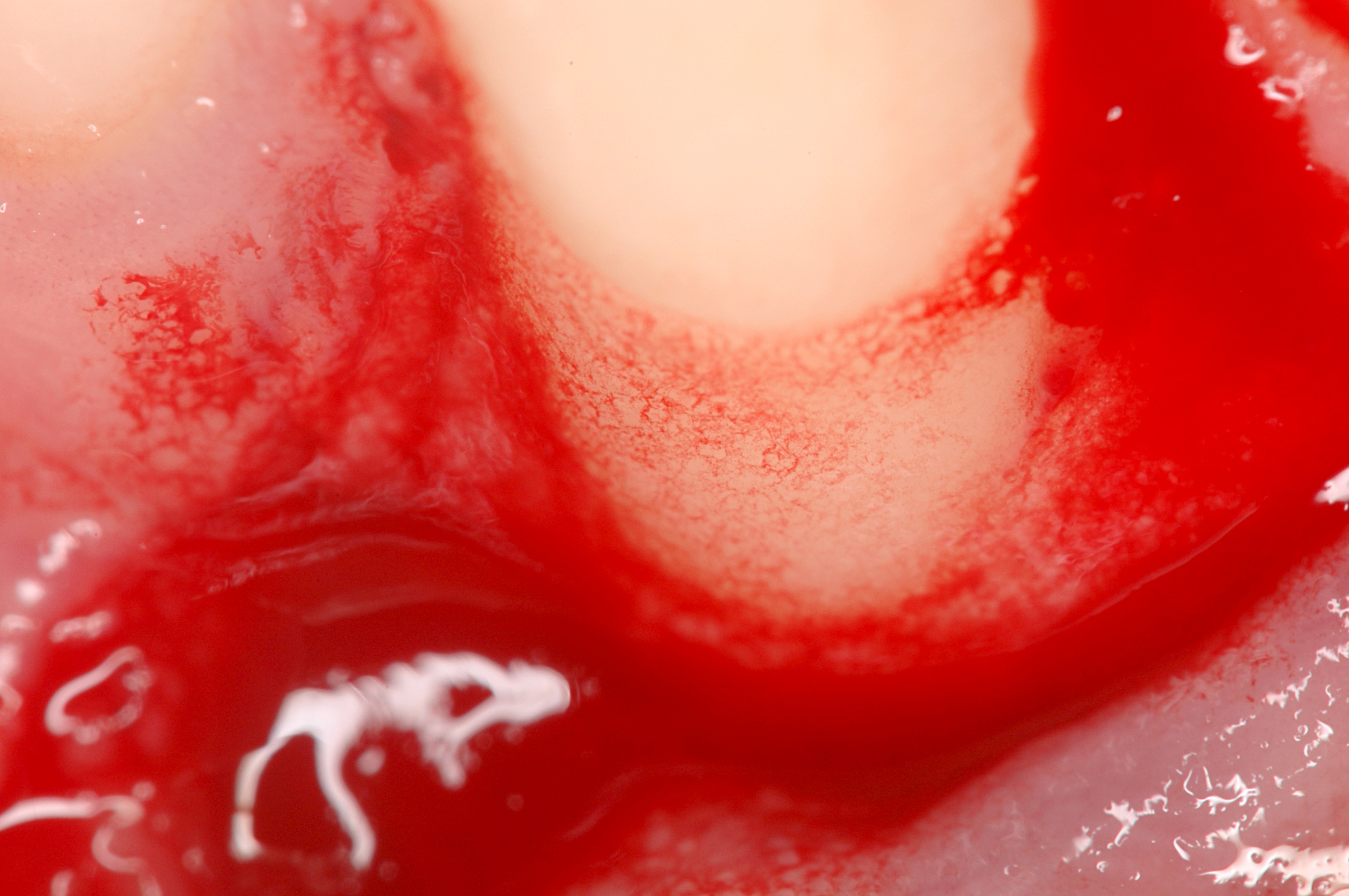
CASO CLINICO: RIGENERAZIONE DEI TESSUTI DURI IN DIFETTI INFRAOSSEI
Ampio difetto infraosseo esteso dal Prof. Andrea Pilloni con rigenerazione dei tessuti duri.
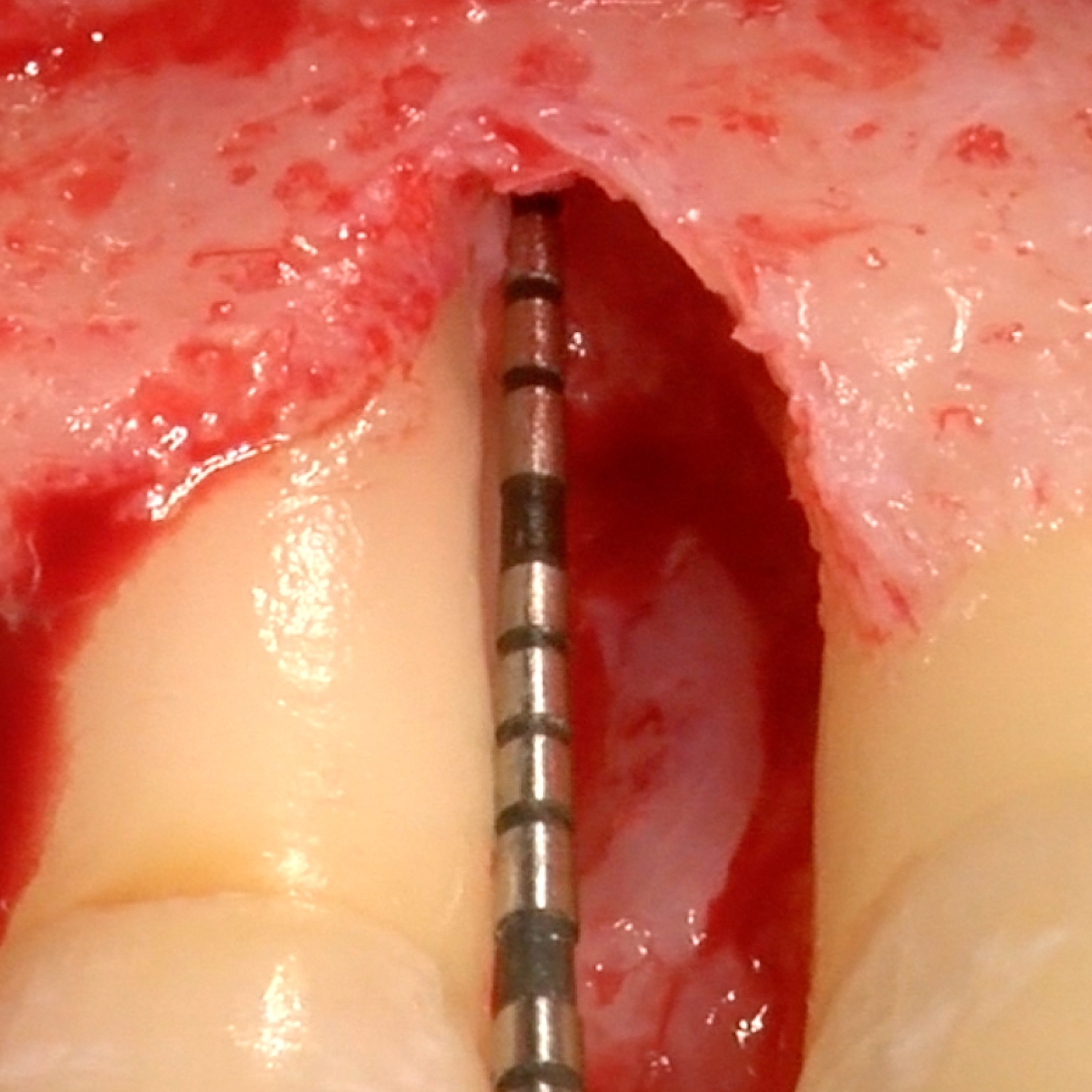
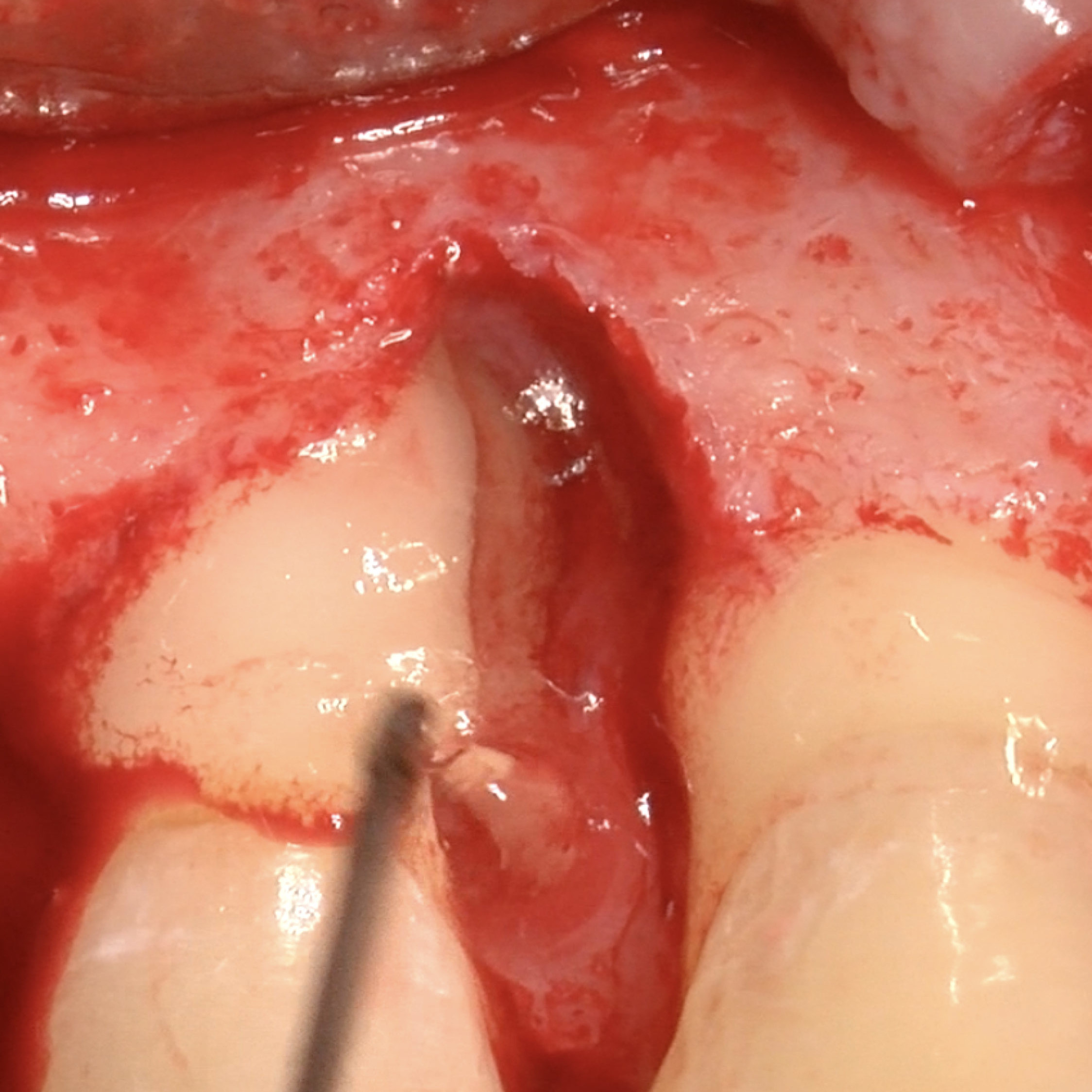
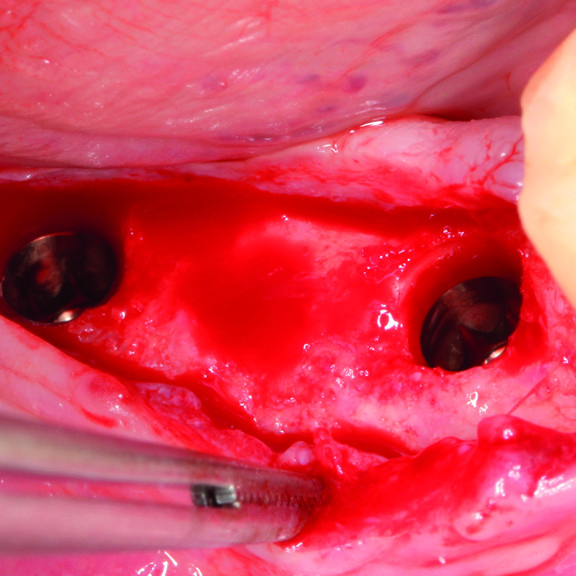
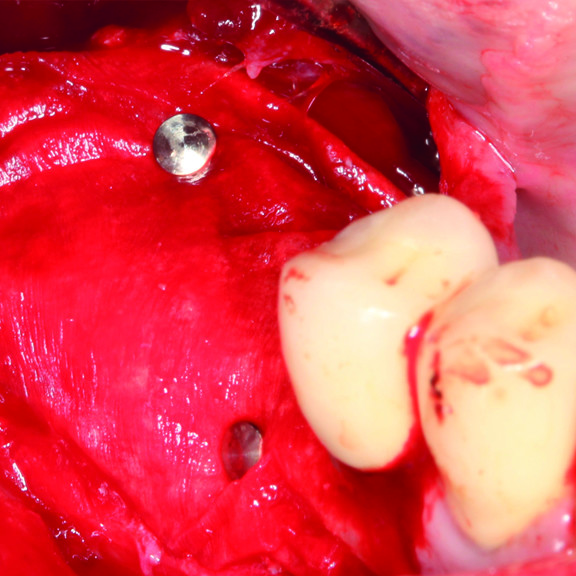
CASO CLINICO : RIGENERAZIONE DEL TESSUTO DURO IN GBR PRIMA DELL'INSERIMENTO DELL'IMPIANTO
Aumento osseo guidato della cresta edentula mandibolare distale da parte del Prof. Darko Božić con rigenerazione dei tessuti duri.
LETTERATURA SCIENTIFICA E STUDI CLINICI
- Hernández-Monjaraz B, Santiago-Osorio E, Monroy-García A, Ledesma-Martínez E, Mendoza-Núñez VM. Cellule staminali mesenchimali di origine dentale per indurre la rigenerazione dei tessuti nella parodontite: A Mini-Review. Int J Mol Sci. 2018 Mar 22;19(4):944. doi: 10.3390/ijms19040944. PMID: 29565801; PMCID: PMC5979585.
- Pihlstrom BL, Michalowicz BS, Johnson NW. Malattie parodontali. Lancet. 2005 Nov 19;366(9499):1809-20. doi: 10.1016/S0140-6736(05)67728-8. PMID: 16298220.
- Hasan I, Heinemann F, Bourauel C. La relazione tra il riassorbimento osseo intorno agli impianti dentali e il design del moncone: uno studio clinico preliminare di 1 anno. Int J Prosthodont. 2011;24(5):457-9.
- Maiorana C, Sigurta D, Mirandola A, Garlini G, Santoro F. Il riassorbimento osseo intorno agli impianti dentali inseriti nei seni innestati: follow-up clinico e radiologico fino a 4 anni. Int J Oral Maxillofac Implants. 2005;20(2):261-6.
- Anushi, M.; Suresh, K. Rigenerazione ossea parodontale in difetti intraossei utilizzando un innesto osseo osteoconduttivo rispetto alla combinazione di innesto osseo osteoconduttivo e osteostimolativo: Uno studio comparativo. Dent. Res. J. 2015, 12, 25-30.
- Zhou, M.; Geng, Y.-M.; Li, S.-Y.; Yang, X.-B.; Che, Y.-J.; Pathak, J.L.; Wu, G. L'impalcatura nanocristallina a base di idrossiapatite adsorbe e rilascia in modo sostenuto il fattore di crescita osteoinduttivo e facilita la rigenerazione ossea nel modello ectopico dei topi. J. Nanomater. 2019, 2019, 10.
- Chen, M.; Xu, Y.; Zhang, T.; Ma, Y.; Liu, J.; Yuan, B.; Chen, X.; Zhou, P.; Zhao, X.; Pang, F. Fogli di cellule staminali mesenchimali: Una nuova strategia basata sulle cellule per la riparazione e la rigenerazione ossea. Biotechnol. Lett. 2019, 41, 305-318.
- Lee JH, Yi GS, Lee JW, Kim DJ. Caratterizzazione fisico-chimica del materiale da innesto di derivazione ossea suina e confronto con xenotrapianti bovini per applicazioni dentali. J Periodontal Implant Sci. 2017 Dec;47(6):388-401. https://doi.org/10.5051/jpis.2017.47.6.388
- Ivanovski, S.; Vaquette, C.; Gronthos, S.; Hutmacher, D.; Bartold, P. Multiphasic scaffolds for periodontal tissue engineering. J. Dent. Res. 2014, 93, 1212-1221,21
- Park CH, Kim KH, Lee YM, Seol YJ. Strategie avanzate di ingegneria per la rigenerazione del complesso parodontale. Materials (Basilea). 2016 Jan 18;9(1):57. doi: 10.3390/ma9010057. PMID: 28787856; PMCID: PMC5456552.
- Sakkas A, Wilde F, Heufelder M, Winter K, Schramm A. Gli innesti ossei autogeni in implantologia orale sono ancora un "gold standard"? Una revisione consecutiva di 279 pazienti con 456 procedure cliniche. Int J Implant Dent. 2017 Dec;3(1):23. doi: 10.1186/s40729-017-0084-4. Epub 2017 Jun 1. PMID: 28573552; PMCID: PMC5453915.
- Reynolds MA, Aichelmann-Reidy ME, Branch-Mays GL. Rigenerazione del tessuto parodontale: innesti di sostituzione ossea. Dent Clin North Am. 2010 Jan;54(1):55-71. doi: 10.1016/j.cden.2009.09.003. PMID: 20103472.
- Keith, J.D., Jr.; Petrungaro, P.; Leonetti, J.A.; Elwell, C.W., Jr.; Zeren, K.J.; Caputo, C.; Nikitakis, N.G.;Schöpf, C.;Warner, M.M. Valutazione clinica e istologica di un allotrapianto a blocco mineralizzato: Risultati del periodo di sviluppo (2001-2004). Int. J. Periodont. Restor. Dent. 2006, 26, 320-327.
- Hölzer A, Pietschmann MF, Rösl C, Hentschel M, Betz O, Matsuura M, Jansson V, Müller PE. L'interrelazione dei parametri microstrutturali trabecolari del tubercolo maggiore misurati in diverse specie. J Orthop Res. 2012 Mar;30(3):429-34. doi: 10.1002/jor.21525. Pubblicato il 10 agosto 2011. PMID: 21834128.
- Lorenzen E, Follmann F, Jungersen G, Agerholm JS. Una revisione del tratto genitale femminile umano e suino e del sistema immunitario associato nella prospettiva dell'utilizzo di minipig come modello di infezione genitale umana da Chlamydia. Vet Res. 2015 Sep 28;46:116. doi: 10.1186/s13567-015-0241-9. PMID: 26411309; PMCID: PMC4586017.
- Salamanca E, Lee WF, Lin CY, Huang HM, Lin CT, Feng SW, et al. Un nuovo innesto suino per la rigenerazione di difetti ossei. Materials (Basilea) 2015;8:2523-36.
- Salamanca E, Lee WF, Lin CY, Huang HM, Lin CT, Feng SW, et al. Un nuovo innesto suino per la rigenerazione di difetti ossei. Materials (Basilea) 2015;8:2523-36.
- Ramírez-Fernández M, Calvo-Guirado JL, Delgado-Ruiz RA, Maté-Sánchez Del Val JE, Vicente-Ortega V, Meseguer-Olmos L. Risposta ossea alle idrossiapatiti a porosità aperta di origine animale (suina [OsteoBiol mp3] e bovina [Endobon]): uno studio radiologico e istomorfometrico. Clin Oral Implants Res. 2011 Jul;22(7):767-773. doi: 10.1111/j.1600-0501.2010.02058.x. Epub 2011 Jan 18. Ritirato in: Clin Oral Implants Res. 2018 Jun;29(6):666. PMID: 21244497.
- Go A, Kim SE, Shim KM, Lee SM, Choi SH, Son JS, Kang SS. Effetto osteogenico di particelle ossee suine riscaldate a bassa temperatura in un modello di difetto calvariale di ratto. J Biomed Mater Res A. 2014 Oct;102(10):3609-17. doi: 10.1002/jbm.a.35022. Epub 2013 Nov 18. PMID: 24248774.].
- Risultati dei test interni, dati in archivio.
- Stiller M. et al. "Performance dei granuli di fosfato tricalcico e del mastice, materiali da innesto osseo dopo l'aumento bilaterale del pavimento del seno mascellare nell'uomo" Biomaterials 2014;35(10):3154-3163.
- Mendes RM et al. "Lo ialuronato di sodio accelera il processo di guarigione nelle orbite dentali di ratto "Arch Oral Biol 2008; 53:1155-1162
- Asparuhova M, Kiryak D, Eliezer M, Mihov D, Sculean A. "Attività di due preparazioni di ialuronano su fibroblasti orali umani primari". J Periodontal Res 2018 Sep 27. Epub 2018 Sep 27
- Elkarargy A. Conservazione degli zoccoli alveolari mediante idrossiapatite / beta fosfato tricalcico con acido ialuronico (studio istomorfometrico). J Am Sci 2013; 9(1): 556-563]. (ISSN: 1545-1003). http://www.jofamericanscience.org. 78
- King SR, Hickerson WL, Proctor KG. Azioni benefiche dell'acido ialuronico esogeno sulla guarigione. Chirurgia 1991;109(1):76-84
- Brett D. Una rassegna delle medicazioni per ferite a base di collagene e di collagene. Wounds 2008;20(12).
- King, S.R., Hickerson, W.L. e Proctor, K.G. (1991) Azioni benefiche dell'acido ialuronico esogeno sulla guarigione delle ferite. Chirurgia, 109, 76-86.
- Deligianni DD, Katsala ND, Koutsoukos PG, Missirlis YF, Effect of Surface Roughness of Hydroxyapatite on Human Bone Marrow Cell Adhesion, Proliferation, Differentiation and Detachment Strength. Elsevier Biomaterials 22 (2001) 87-96.
- Shu-Thung L et al. (2014) Isolation and Characterization of a Porous Carbonate Apatite From Porcine Cancellous Bone. Science, Technology, Innovation, Aug: 1-13 Brett D. A Review of Collagen and Collagen-based Wound Dressings. Ferite 2008;20(12)
- Nichols A, Burns DC, Christopher R. Studi sulla sterilizzazione di tessuti muscolo-scheletrici ossei e tendinei umani mediante anidride carbonica supercritica. Journal of Orthopaedics 2009.
- Sawada K, Terada D, Yamaoka T, Kitamura S, Fujisato T. Rimozione di cellule con anidride carbonica supercritica per tessuti artificiali acellulari. J Chemical Technol Biotechnol 2008;83(6):943-949.
- Fawzy ES. et al. Applicazione locale di gel di ialuronano in concomitanza con la chirurgia parodontale: uno studio randomizzato e controllato.Clin Oral Invest 2012;16:1229-1236
- Briguglio, F. et al. Trattamento dei difetti parodontali infraossei con un biopolimero riassorbibile di acido ialuronico: uno studio clinico randomizzato. Quintessence Int2013;44:231-240
- Kessiena L. Aya et al. "Lo ialuronano nella guarigione delle ferite: Rediscovering a major player. Wound Rep Reg 2014;22:579-593.Dental Journal. (2017) Vol.42:104-11.
- Sasaki T, Watanabe C, Stimolazione dell'osteoinduzione nella guarigione delle ferite ossee da parte dell'acido ialuronico ad alta molecolarità. Bone. Vol. 16. No.1 Gennaio 1995:9-15
- Ghada Bassiouny A. "Approccio bioispirato per la funzionalizzazione degli impianti dentali: An Experimental Study Evaluating the Effect of Hyaluronate as Bioactive Implant Coating". J Am Sci 2013;9(11):187-192]. (ISSN: 1545-1003). http://www.jofamericanscience.org. 25
- Shamma MM, Ayad SS, El-dibany RM, Nagui DA 'Valutazione dell'effetto dell'acido ialuronico miscelato con fosfato di calcio bifasico sulla guarigione ossea intorno agli impianti dentali' Alexandria Dental Journal. (2017) Vol.42 Pagine:104-11
- Kim JJ, Song HY, Ben Amara H, Kyung-Rim K, Koo KT. L'acido ialuronico migliora la formazione ossea nelle cavità estrattive con patologia cronica: Uno studio pilota nei cani. J Periodontol. 2016;87(7):790-795. doi:10.1902/jop.2016.150707
- Bracey DN, Seyler TM, Jinnah AH, Lively MO, Willey JS, Smith TL, et al. Uno scaffold osseo decellularizzato derivato da xenotrapianto suino per uso clinico come sostituto dell'innesto osseo: una valutazione critica della lavorazione e della struttura. J Funct Biomater. 2018;9(3):45.https://doi.org/10.3390/jfb9030045
- Renzo et al: Cambiamenti dimensionali dei tessuti dopo la conservazione della cresta alveolare con diversi xenotrapianti associati a una membrana di collagene. Risultati alla chirurgia di rientro a 4 mesi. Int Arch Oral Maxillofac Surg, 2017, 1:003 12.
- Guarnieri R, Di Nardo D, Di Giorgio G, Miccoli G, Testarelli L. Efficacia dello xenotrapianto e della membrana riassorbibile di derivazione porcina nell'aumento di zoccoli estrattivi posteriori con un grave difetto di parete. Una valutazione radiografica e tomografica. J Oral Maxillofac Res. 2019 Mar 31;10(1):e3. doi: 10.5037/jomr.2019.10103. PMID: 31086644; PMCID: PMC6498814
- Pirnazar P. et al. "Effetti batteriostatici dell'acido ialuronico". Giornale di Parodontologia 1999;70:370-374
- Eliezer M, Sculean A, Miron RJ, et al. "L'acido ialuronico rallenta la degradazione della membrana di collagene nei ratti diabetici non controllati". J Periodontal Res. 2019;00:1-9. https ://doi.org/10.1111/jre.12665
- Longaker T et al. "Studi sulla guarigione delle ferite fetali: V. Una presenza prolungata di acido ialuronico caratterizza la guarigione delle ferite fetali". Ann. Surg. 1991; April:292-296.
- Mast BA et al. "L'acido ialuronico modula la proliferazione, il collagene e la sintesi proteica dei fibroblasti fetali in coltura". Matrix,1993;13:441–446.
- Asparuhova MB et al. 'Attività di due preparazioni di ialuroni su fi broblasti orali umani primari'. J Periodont Res.2018;00:1-13.
- Salbach J et al. "Potenziale rigenerativo dei glicosaminoglicani per pelle e ossa". J Mol Med 2012;90:625-635.