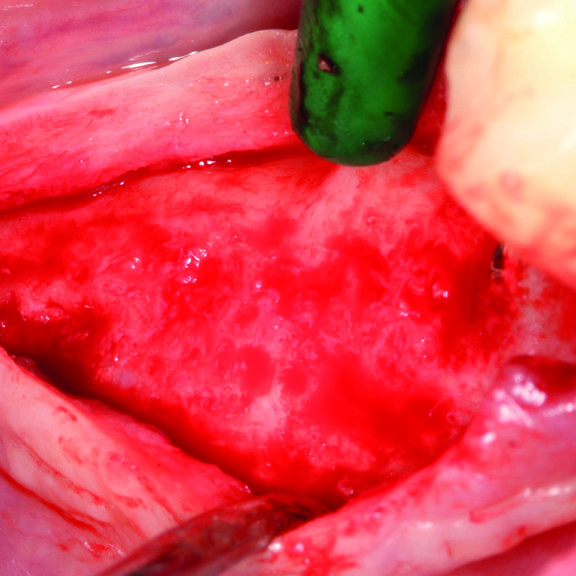
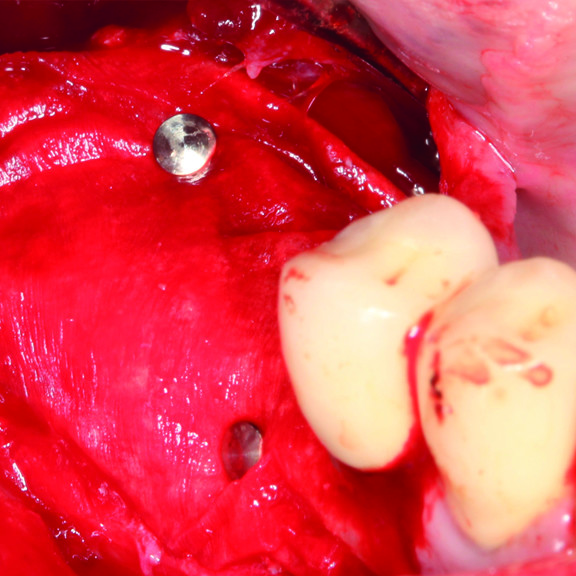
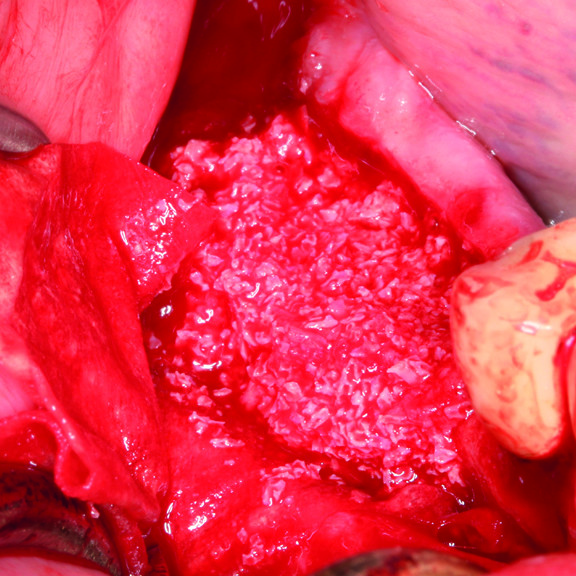
KNOCHENREGENERATION
STÄRKUNG DER REGENERATIONSFÄHIGKEIT
Bei REGEDENT konzentrieren wir uns auf die Regeneration von Hartgewebe, indem wir ein künstliches Gerüst durch körpereigene Knochenzellen ersetzen und so für ein stabiles Knochenvolumen sorgen und die Anzahl der Operationen minimieren. Letztendlich profitieren die Patienten von einer besseren Vorhersagbarkeit des Behandlungserfolgs in Verbindung mit langfristigen Ergebnissen.
WAS IST DIE KNOCHENREGENERATION?
Der Verlust von Hartgewebe/Knochen ist ein wichtiges Merkmal in der Zahnmedizin. In der Parodontologie können beispielsweise Krankheitserreger, genetische Faktoren und Umwelteinflüsse, wie z. B. Tabakkonsum, zum Verlust von Hartgewebe führen. Dies kann zu Zahnbewegungen, Verschiebungen und schließlich zum Zahnverlust führen [1,2].
In der Implantologie bringt die Verwendung von Zahnimplantaten für die Patienten erhebliche Vorteile mit sich. Allerdings birgt sie auch einige Risiken, die durch die Verwendung inerter Materialien in direktem Kontakt mit dem Knochen und das Fehlen des parodontalen Ligaments (PDL) verursacht werden. Das PDL dient als Puffer zur Verteilung der Kaukräfte und kann, wenn es fehlt, zu einer Resorption des Kieferknochens führen [3,4].
VIER ARTEN DER KNOCHENREGENERATION
Zur Verbesserung des Osteogeneseprozesses werden verschiedene Techniken eingesetzt, z. B. Knochentransplantate [5], Gerüste [6], Stammzellen [7] und Wachstumsfaktoren. Knochentransplantate helfen, die durch den fehlenden oder beschädigten Knochen entstandenen physischen Lücken zu füllen, sorgen für strukturelle Stabilität und stimulieren das Wachstum von Knochengewebe [8]. Knochentransplantate werden in vier Gruppen eingeteilt [9, 10]. Erstens wird autogener Knochen als "Goldstandard" für den Knochenersatz angesehen [11], da er mit minimalem Behandlungsaufwand verwendet wird und das effizienteste und am schnellsten heilende Knochenersatzmaterial ist [8]. Klinische Anwendungen haben gezeigt, dass neuer Knochen und neue parodontale Bindegewebsanhänge erhalten werden [12].
Zweitens bieten Gewebebanken verschiedene Arten von allogenen Knochentransplantaten an [13]. Sie sind bekanntermaßen nicht so wirksam wie Autotransplantate, da umfangreiche chemische Behandlungen erforderlich sind, um eine potenzielle Infektiosität zu verhindern. Dadurch wird die hierarchische Struktur des Knochens gestört und eine erhebliche Menge der für eine effiziente Knochenregeneration erforderlichen Wachstumsfaktoren entfernt [8].
Drittens weisen Xenotransplantate deutliche Vorteile auf. Sie werden in Massenproduktion zu erschwinglichen Verarbeitungskosten hergestellt. Da sie jedoch aus dem Knochengewebe anderer Spezies stammen, unterscheiden sich ihre ursprünglichen osteologischen Merkmale von denen des menschlichen Knochengewebes. Einige der Xenotransplantate, wie z. B. aus Schweineknochen stammende Substitute, unterstützen jedoch die Knochenregeneration aufgrund ihrer physikalisch-chemischen Eigenschaften und ihrer Struktur, die der des menschlichen Knochens ähnelt [8, 14,15]. Außerdem hat Schweineknochen ein relativ geringes Zoonoserisiko [16].
Schließlich werden synthetische Transplantate wie Hydroxylapatit aufgrund ihrer Osteokonduktion, Härte und Akzeptanz durch den Knochen verwendet. Einige synthetische Knochentransplantate bestehen aus Kalziumkarbonat, das immer seltener verwendet wird, weil es in kurzer Zeit vollständig resorbierbar ist und den Knochenabbau erleichtert. Diese letzte Kategorie von Transplantatmaterial wird zunehmend erforscht, da sie attraktive Vorteile bietet, die Xenotransplantatmaterial nicht hat.
ZEHN ANZEICHEN FÜR EINE ERFOLGREICHE KNOCHENREGENERATION
- Benutzerfreundliche Handhabung von Transplantatmaterial und Membran für ein kostengünstiges, vorhersehbares Behandlungsprotokoll
- Verwendung von biokompatiblem Material
- Schnelle Stabilisierung von Blutgerinnseln
- Schnelle Angiogenese
- Minimierung des Entzündungsprozesses (Schwellungen, Unbehagen)
- Unauffällige Wundheilung
- Vorhersagbare Knochendichte
- Stabiles Volumen für eine vorhersehbare Implantation
- Resorbierbares Material, um durch körpereigene Zellen ersetzt zu werden und weitere Operationen zu vermeiden
- Zufriedenheit von Patienten und Klinikern
UNSERE LÖSUNG ZUR KNOCHENREGENERATION
Hyadent BG, Smartbrane, und Smartgraft sind so konzipiert, dass sie die Regeneration von Hartgewebe unterstützen und gemeinsam noch benutzerfreundlicher sind.
Das Gel bildet in Verbindung mit dem porösen Knochen in etwa 3 Minuten einen klebrigen Kitt, und durch ihre Zugfestigkeit hält die Membran die augmentierte Stelle gut fest, während sie sich leicht an die Knochenoberfläche anpasst, ohne jedoch zu verkleben. [20] Die in der augmentierten Stelle vorhandene Hyaluronsäure scheint die Knochenbildung durch ihre migratorischen und proliferativen Eigenschaften zu beschleunigen. [21-24]
DIE SYNERGIEN ZWISCHEN UNSEREN REGENERATIVEN PRODUKTEN
Das Portfolio von REGEDENT unterstützt die Regeneration von Hartgewebe. Hyadent BG und Smartbrane tragen zur Stabilisierung des Blutgerinnsels bei [25-26]. Hyaluronsäure zieht die natürlich im Blut vorhandenen Wachstumsfaktoren an und fördert die Vaskularisierung, z. B. mit Hilfe von porösem Knochenersatzmaterial aus Schweinen [27-29].
Das Anhaften und die Proliferation von Knochenzellen werden dann durch die rauen Oberflächen der Schweinemembran und des Knochenersatzmaterials erleichtert [26, 28-31]. Gleichzeitig fördert die vernetzte hochmolekulare Hyaluronsäure die gesamte Zellproliferation [32-35]. Hyadent BG und Smartgraft tragen zur Beschleunigung der Knochenheilung bei und zeigen gleichzeitig ein ausgewogenes Remodelling des Knochenvolumens [26, 36-41].
Während des Knochenheilungsprozesses profitiert der klebrige Knochen aus Hyadent BG und Smartgraft von seinem natürlichen bakteriostatischen Schutzschild [42]. Die starke Kollagenmembran hält die transplantierte Stelle während des Heilungsprozesses zusammen. Ihre Erhaltungsfunktion wird durch die verlangsamte Kollagenase dank der früheren Beschichtung der Membran mit Hyadent BG sogar verlängert [43].
Da Hyadent BG nicht nur die ästhetische, sondern auch die funktionelle Struktur um den Zahn/das Implantat herum wiederherstellt, wird davon ausgegangen, dass es eher regeneriert als repariert [44-47].
Die Wundheilungseigenschaften des REGEDENT-Portfolios sind ausführlich beschrieben in Regeneration von Weichgewebe.
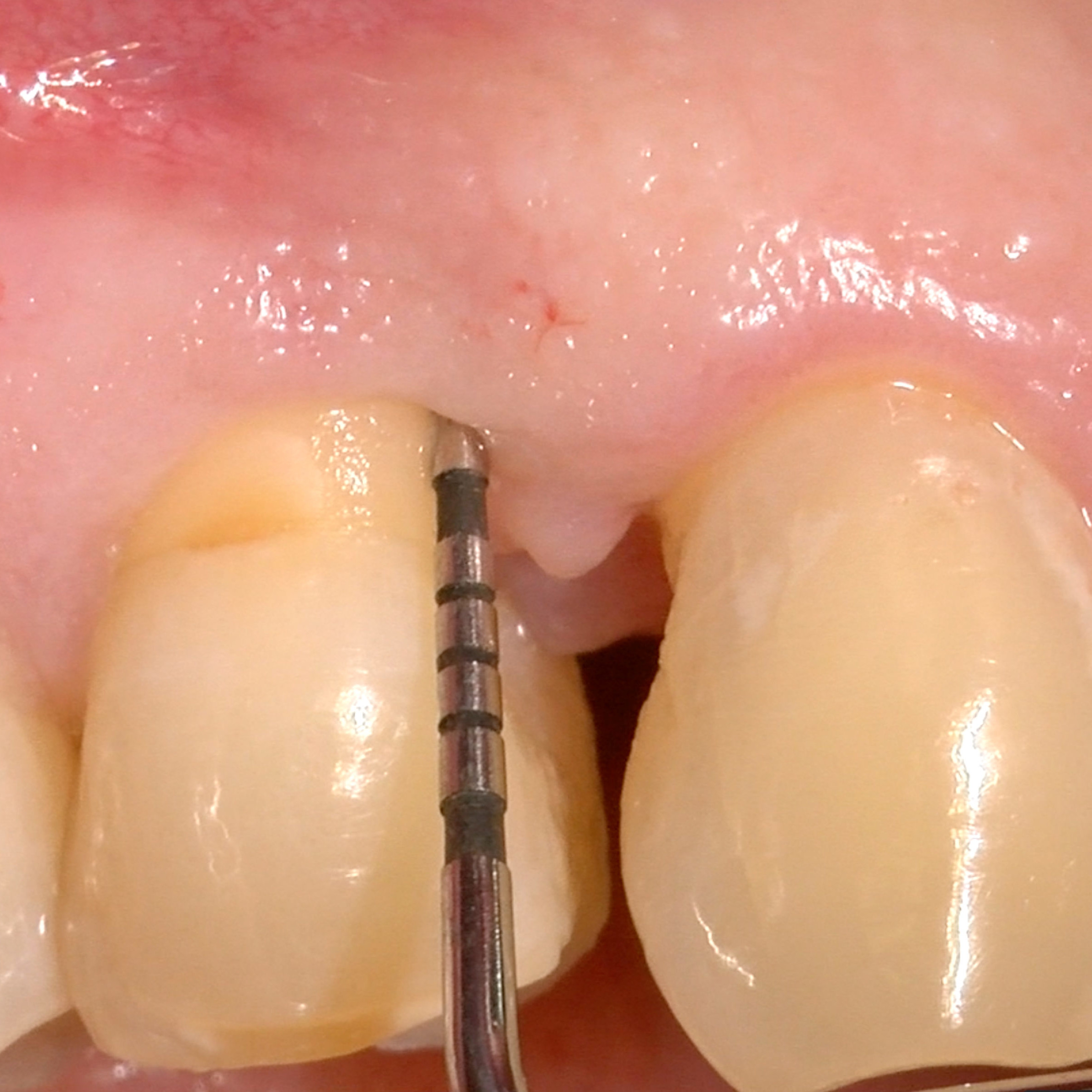
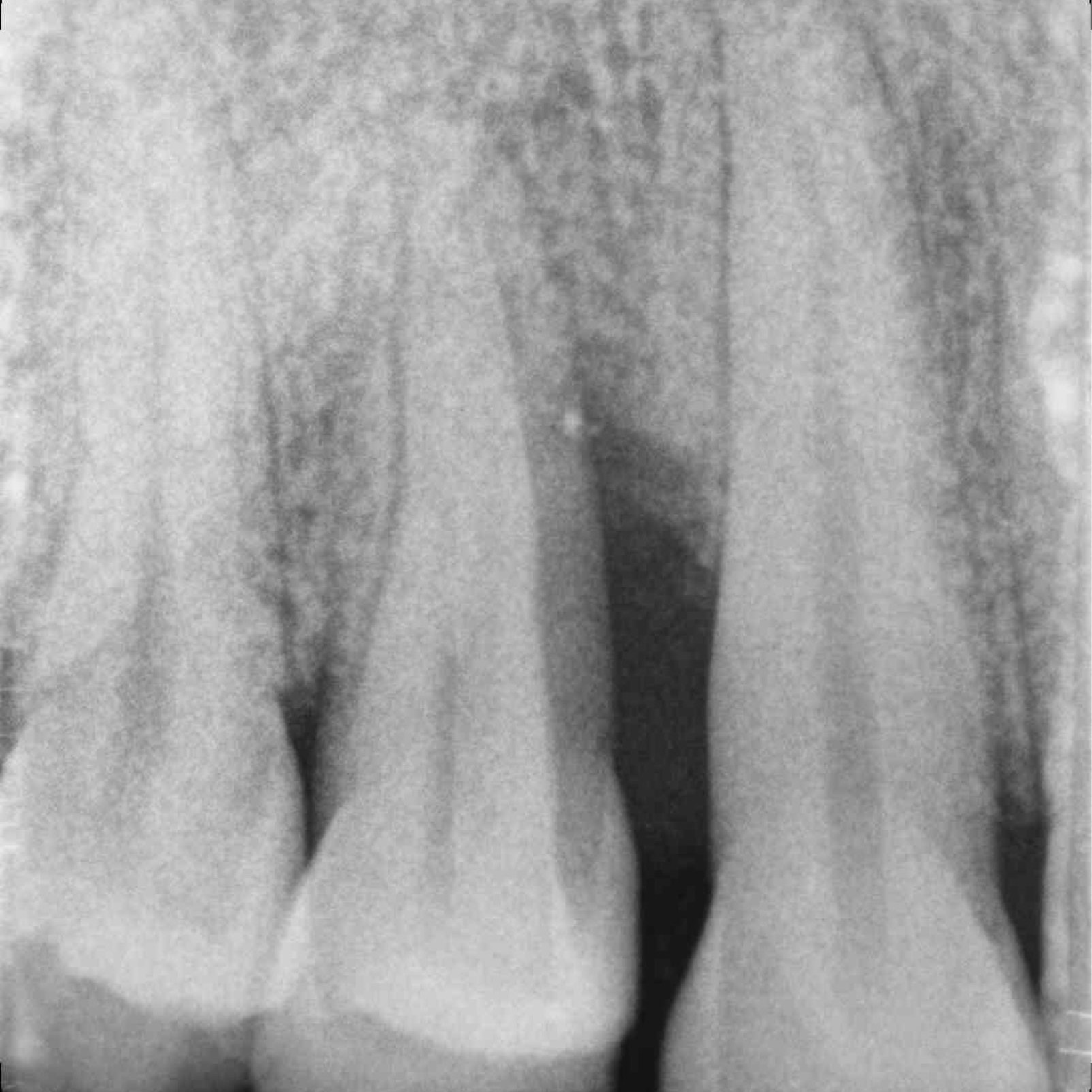
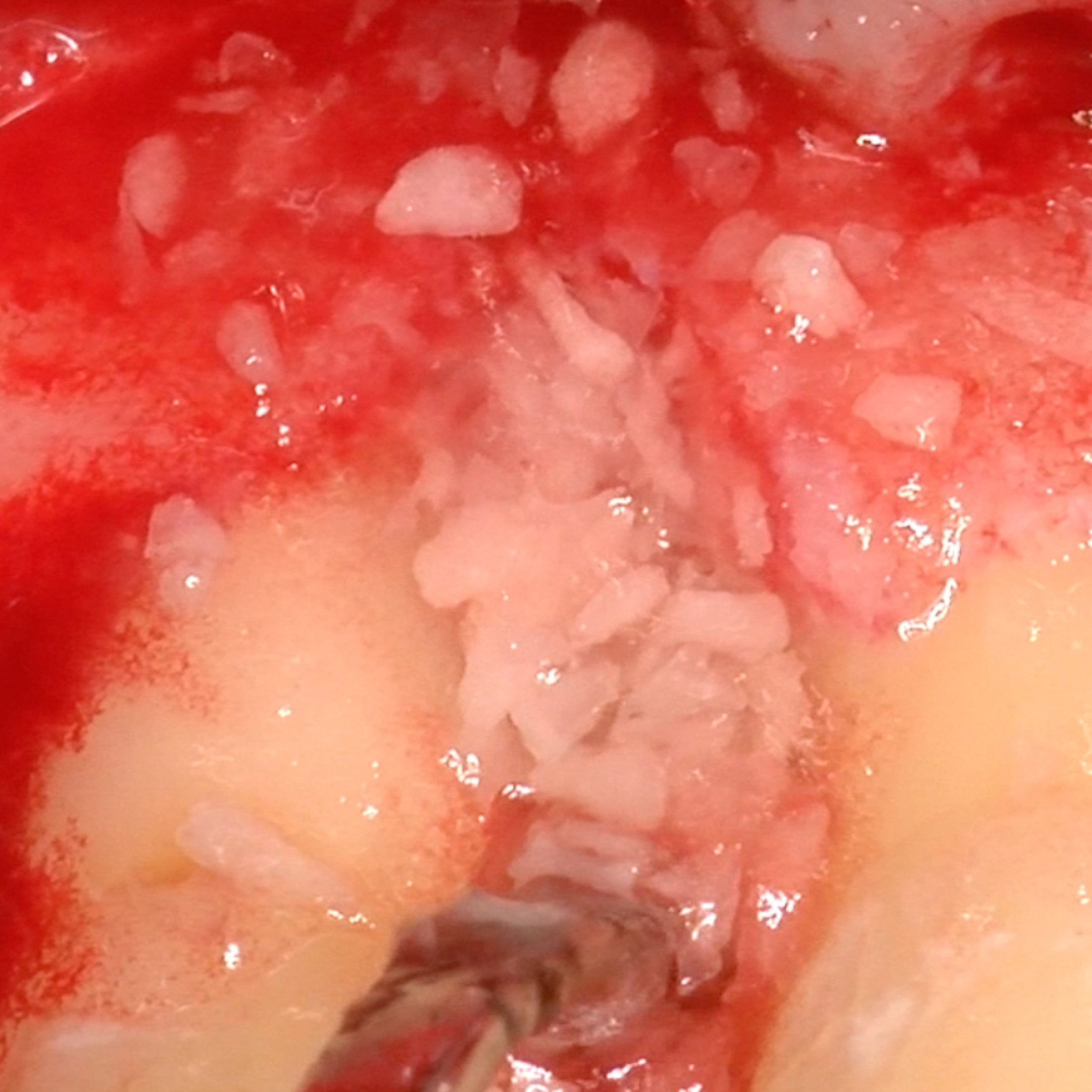
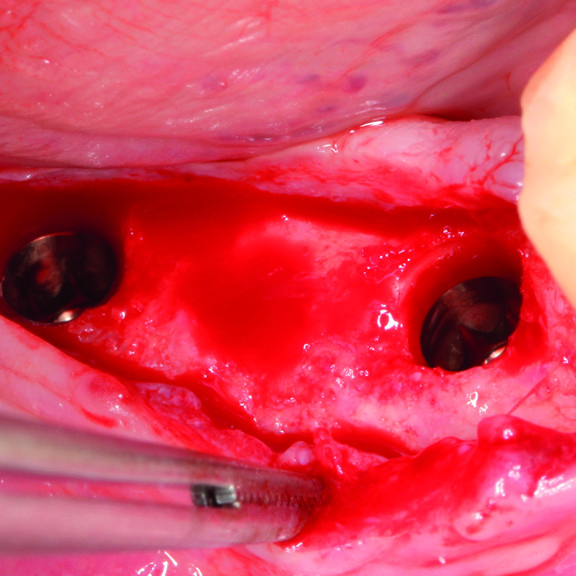
KLINISCHER FALL: KNOCHENREGENERATION VOR DEM EINSETZEN EINES IMPLANTATS
Breit angelegter infraalveolärer Defekt von Prof. Andrea Pilloni mit Hartgeweberegeneration.
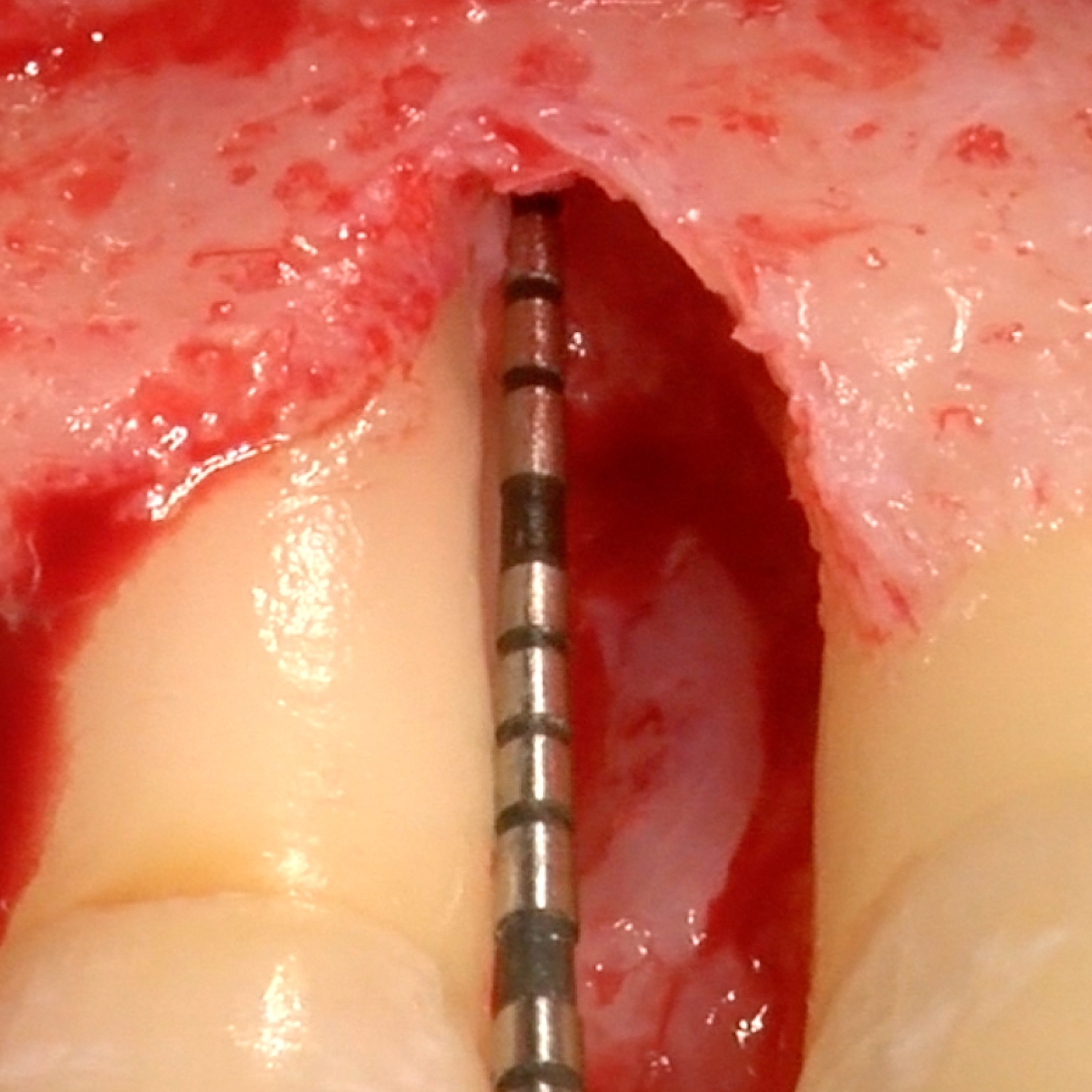
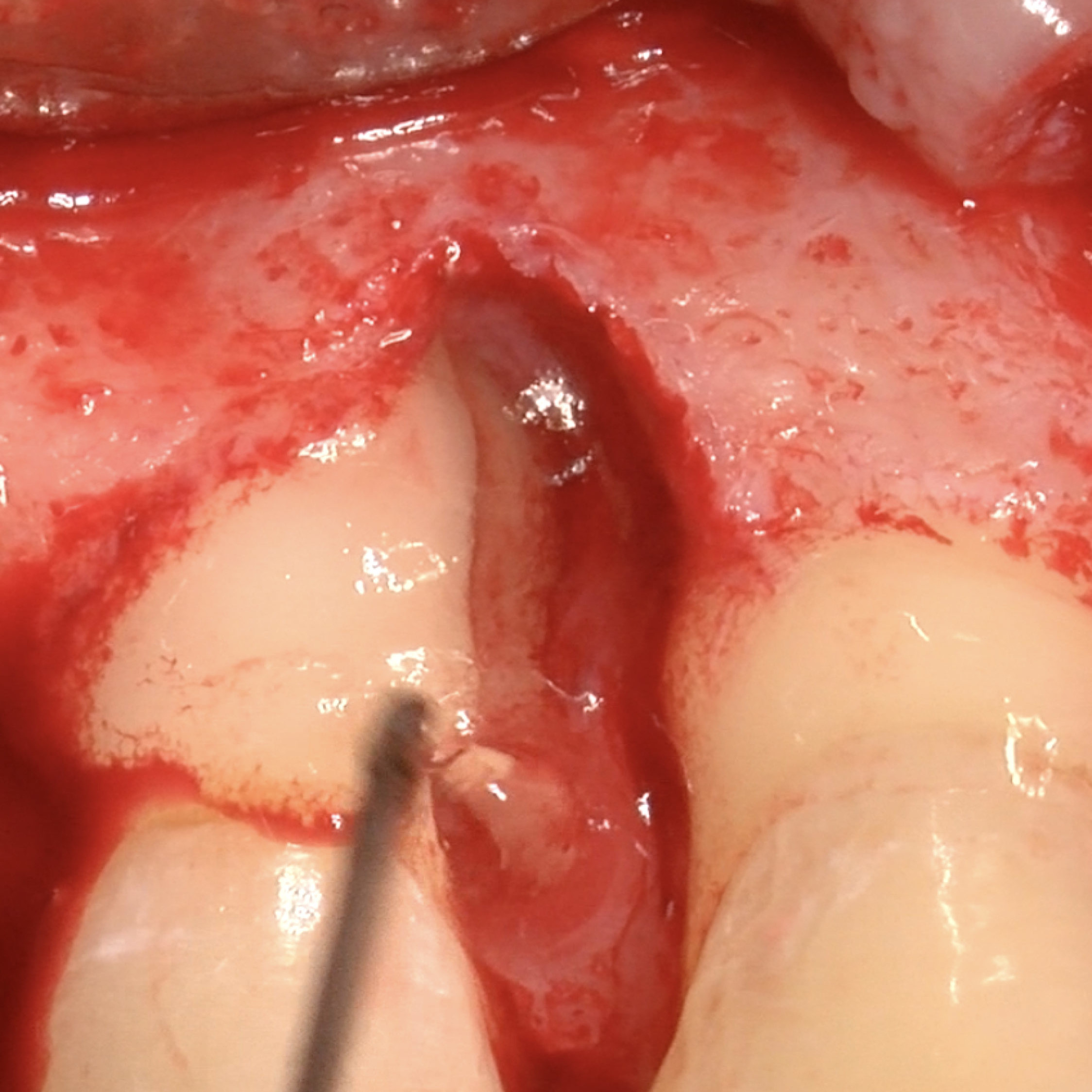
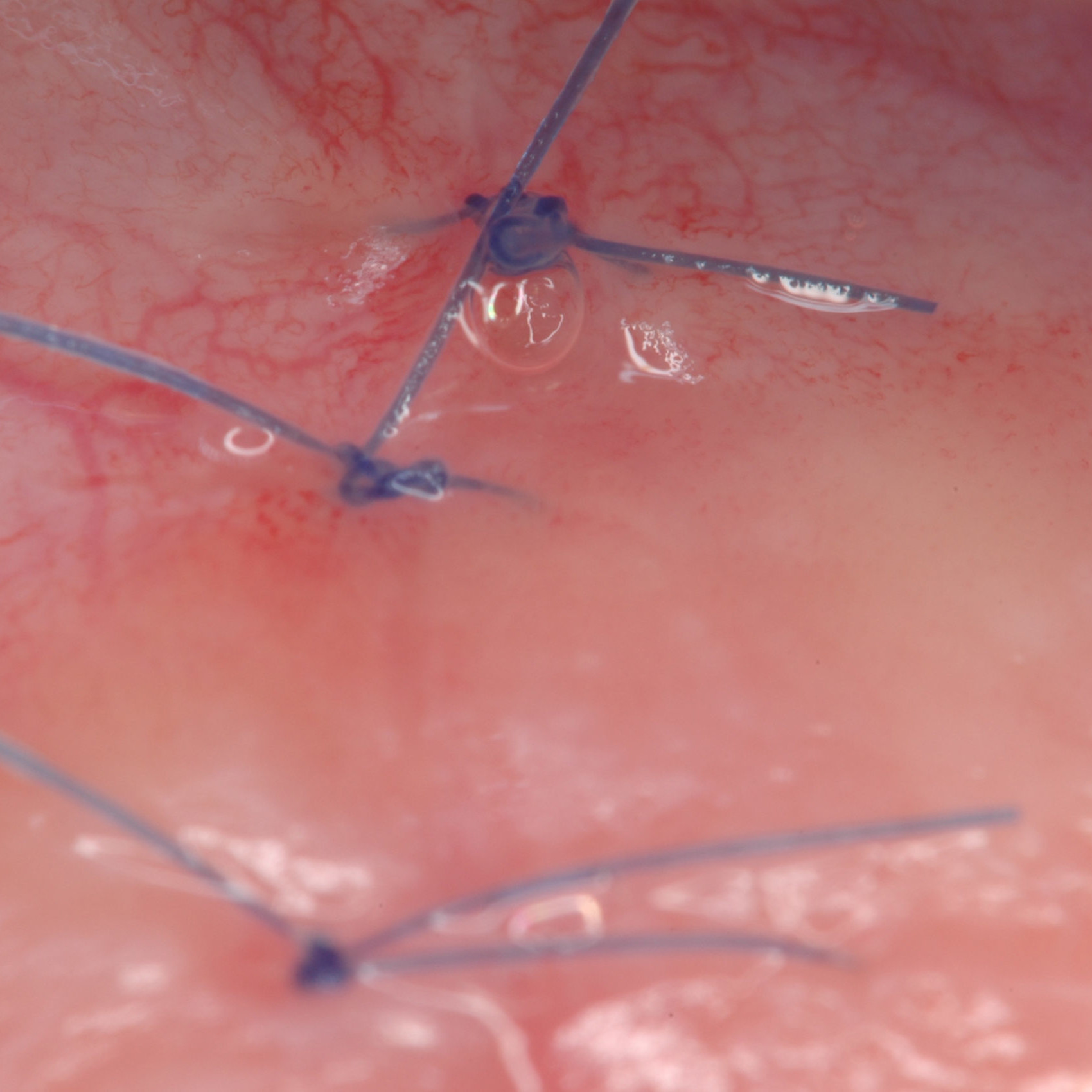
KLINISCHER FALL: REGENERIERUNG VON HARTGEWEBE IN GBR VOR DER IMPLANTATION
Geführte Knochenaugmentation des distalen zahnlosen Unterkieferkamms durch Prof. Darko Božić mit Hartgewebsregeneration.
WISSENSCHAFTLICHE LITERATUR & KLINISCHE STUDIEN
- Hernández-Monjaraz B, Santiago-Osorio E, Monroy-García A, Ledesma-Martínez E, Mendoza-Núñez VM. Mesenchymale Stammzellen zahnmedizinischen Ursprungs zur Einleitung der Geweberegeneration bei Parodontitis: A Mini-Review. Int J Mol Sci. 2018 Mar 22;19(4):944. doi: 10.3390/ijms19040944. PMID: 29565801; PMCID: PMC5979585.
- Pihlstrom BL, Michalowicz BS, Johnson NW. Parodontalerkrankungen. Lancet. 2005 Nov 19;366(9499):1809-20. doi: 10.1016/S0140-6736(05)67728-8. PMID: 16298220.
- Hasan I, Heinemann F, Bourauel C. The relationship of bone resorption around dental implants to abutment design: a preliminary 1-year clinical study. Int J Prosthodont. 2011;24(5):457-9.
- Maiorana C, Sigurta D, Mirandola A, Garlini G, Santoro F. Knochenresorption um Zahnimplantate, die in transplantierte Kieferhöhlen eingesetzt wurden: klinische und radiologische Nachuntersuchung nach bis zu 4 Jahren. Int J Oral Maxillofac Implants. 2005;20(2):261-6.
- Anushi, M.; Suresh, K. Parodontale Knochenregeneration bei intraossären Defekten mit osteokonduktivem Knochentransplantat im Vergleich zu einer Kombination aus osteokonduktivem und osteostimulativem Knochentransplantat: Eine vergleichende Studie. Dent. Res. J. 2015, 12, 25-30.
- Zhou, M.; Geng, Y.-M.; Li, S.-Y.; Yang, X.-B.; Che, Y.-J.; Pathak, J.L.; Wu, G. Nanokristallines Gerüst auf Hydroxyapatitbasis adsorbiert und setzt nachhaltig osteoinduktiven Wachstumsfaktor frei und erleichtert die Knochenregeneration in einem ektopischen Mausmodell. J. Nanomater. 2019, 2019, 10.
- Chen, M.; Xu, Y.; Zhang, T.; Ma, Y.; Liu, J.; Yuan, B.; Chen, X.; Zhou, P.; Zhao, X.; Pang, F. Mesenchymal stem cell sheets: Eine neue zellbasierte Strategie zur Knochenreparatur und -regeneration. Biotechnol. Lett. 2019, 41, 305-318.
- Lee JH, Yi GS, Lee JW, Kim DJ. Physicochemical characterization of porcine bone-derived grafting material and comparison with bovine xenografts for dental applications. J Periodontal Implant Sci. 2017 Dec;47(6):388-401. https://doi.org/10.5051/jpis.2017.47.6.388
- Ivanovski, S.; Vaquette, C.; Gronthos, S.; Hutmacher, D.; Bartold, P. Multiphasic scaffolds for periodontal tissue engineering. J. Dent. Res. 2014, 93, 1212-1221,21
- Park CH, Kim KH, Lee YM, Seol YJ. Moderne technische Strategien für die Regeneration parodontaler Komplexe. Materials (Basel). 2016 Jan 18;9(1):57. doi: 10.3390/ma9010057. PMID: 28787856; PMCID: PMC5456552.
- Sakkas A, Wilde F, Heufelder M, Winter K, Schramm A. Autogene Knochentransplantate in der oralen Implantologie - immer noch ein "Goldstandard"? Eine konsekutive Untersuchung von 279 Patienten mit 456 klinischen Eingriffen. Int J Implant Dent. 2017 Dec;3(1):23. doi: 10.1186/s40729-017-0084-4. Epub 2017 Jun 1. PMID: 28573552; PMCID: PMC5453915.
- Reynolds MA, Aichelmann-Reidy ME, Branch-Mays GL. Regeneration von parodontalem Gewebe: Knochenersatztransplantate. Dent Clin North Am. 2010 Jan;54(1):55-71. doi: 10.1016/j.cden.2009.09.003. PMID: 20103472.
- Keith, J.D., Jr.; Petrungaro, P.; Leonetti, J.A.; Elwell, C.W., Jr.; Zeren, K.J.; Caputo, C.; Nikitakis, N.G.;Schöpf, C.;Warner, M.M. Clinical and histologic evaluation of a mineralized block allograft: Ergebnisse aus dem Entwicklungszeitraum (2001-2004). Int. J. Periodont. Restor. Dent. 2006, 26, 320-327.
- Hölzer A, Pietschmann MF, Rösl C, Hentschel M, Betz O, Matsuura M, Jansson V, Müller PE. The interrelation of trabecular microstructural parameters of the greater tubercle measured for different species. J Orthop Res. 2012 Mar;30(3):429-34. doi: 10.1002/jor.21525. Epub 2011 Aug 10. PMID: 21834128.
- Lorenzen E, Follmann F, Jungersen G, Agerholm JS. A review of the human vs. porcine female genital tract and associated immune system in the perspective of using minipigs as a model of human genital Chlamydia infection. Vet Res. 2015 Sep 28;46:116. doi: 10.1186/s13567-015-0241-9. PMID: 26411309; PMCID: PMC4586017.
- Salamanca E, Lee WF, Lin CY, Huang HM, Lin CT, Feng SW, et al. A novel porcine graft for regeneration of bone defects. Materials (Basel) 2015;8:2523-36.
- Salamanca E, Lee WF, Lin CY, Huang HM, Lin CT, Feng SW, et al. A novel porcine graft for regeneration of bone defects. Materials (Basel) 2015;8:2523-36.
- Ramírez-Fernández M, Calvo-Guirado JL, Delgado-Ruiz RA, Maté-Sánchez Del Val JE, Vicente-Ortega V, Meseguer-Olmos L. Bone response to hydroxyapatites with open porosity of animal origin (porcine [OsteoBiol mp3] and bovine [Endobon]): a radiological and histomorphometric study. Clin Oral Implants Res. 2011 Jul;22(7):767-773. doi: 10.1111/j.1600-0501.2010.02058.x. Epub 2011 Jan 18. Retraction in: Clin Oral Implants Res. 2018 Jun;29(6):666. PMID: 21244497.
- Go A, Kim SE, Shim KM, Lee SM, Choi SH, Son JS, Kang SS. Osteogenic effect of low-temperature-heated porcine bone particles in a rat calvarial defect model. J Biomed Mater Res A. 2014 Oct;102(10):3609-17. doi: 10.1002/jbm.a.35022. Epub 2013 Nov 18. PMID: 24248774.].
- Interne Testergebnisse, Daten in den Akten.
- Stiller M. et al. 'Performance of β-tricalcium phosphate granules and putty, bone grafting materials after bilateral sinus floor augmentation in humans' Biomaterials 2014;35(10):3154-3163.
- Mendes RM et al. 'Natriumhyaluronat beschleunigt den Heilungsprozess in Zahnhöhlen von Ratten'Arch Oral Biol 2008; 53:1155-1162
- Asparuhova M, Kiryak D, Eliezer M, Mihov D, Sculean A. 'Activity of two hyaluronan preparations on primary human oral fibroblasts'. J Periodontal Res 2018 Sep 27. Epub 2018 Sep 27
- Elkarargy A. Alveolar Sockets Preservation Using Hydroxyapatite / Beta tricalcium Phosphate with Hyaluronic Acid (Histomorphometric study). J Am Sci 2013; 9(1): 556-563]. (ISSN: 1545-1003). http://www.jofamericanscience.org. 78
- King SR, Hickerson WL, Proctor KG. Günstige Auswirkungen von exogener Hyaluronsäure auf die Heilung. Chirurgie 1991;109(1):76-84
- Brett D. A Review of Collagen and Collagen-based Wound Dressings. Wounds 2008;20(12).
- King, S.R., Hickerson, W.L. und Proctor, K.G. (1991) Beneficial Actions of Exogenous Hyaluronic Acid on Wound Healing. Surgery, 109, 76-86.
- Deligianni DD, Katsala ND, Koutsoukos PG, Missirlis YF, Effect of Surface Roughness of Hydroxyapatite on Human Bone Marrow Cell Adhesion, Proliferation, Differentiation and Detachment Strength. Elsevier Biomaterials 22 (2001) 87-96 2.
- Shu-Thung L et al. (2014) Isolation and Characterization of a Porous Carbonate Apatite From Porcine Cancellous Bone. Science, Technology, Innovation, Aug: 1-13 Brett D. A Review of Collagen and Collagen-based Wound Dressings. Wounds 2008;20(12)
- Nichols A, Burns DC, Christopher R. Studies on the Sterilization of Human Bone and Tendon Muscoskeletal Allograft Tissue Using Supercritical Carbon Dioxide. Journal of Orthopaedics 2009.
- Sawada K, Terada D, Yamaoka T, Kitamura S, Fujisato T. Cell removal with supercritical carbon dioxide for acellular artificial tissue. J Chemical Technol Biotechnol 2008;83(6):943-949.
- Fawzy ES. et al. Local application of hyaluronan gel in conjunction with periodontal surgery: a randomized controlled trial.Clin Oral Invest 2012;16:1229-1236
- Briguglio, F. et al. Treatment of infrabony periodontal defects using a resorbable biopolymer of hyaluronic acid:A randomized clinical trial. Quintessence Int2013;44:231-240
- Kessiena L. Aya et al. 'Hyaluronan in wound healing: Rediscovering a major player.' Wound Rep Reg 2014;22:579-593.Dental Journal. (2017) Vol.42:104-11.
- Sasaki T, Watanabe C, Stimulation der Osteoinduktion bei der Heilung von Knochenwunden durch hochmolekulare Hyaluronsäure. Bone. Vol. 16. Nr.1 Januar 1995:9-15
- Ghada Bassiouny A. 'Bioinspirierter Ansatz für die Fuktionalisierung von Zahnimplantaten: Eine experimentelle Studie zur Bewertung der Wirkung von Hyaluronat als bioaktive Implantatbeschichtung". J Am Sci 2013;9(11):187-192]. (ISSN: 1545-1003). http://www.jofamericanscience.org. 25
- Shamma MM, Ayad SS, El-dibany RM, Nagui DA 'Evaluation of the effect of hyaluronic acid mixed with biphasic calcium phosphate on bone healing around dental implants' Alexandria Dental Journal. (2017) Vol.42 Seiten:104-11
- Kim JJ, Song HY, Ben Amara H, Kyung-Rim K, Koo KT. Hyaluronsäure verbessert die Knochenbildung in Extraktionsalveolen mit chronischer Pathologie: Eine Pilotstudie an Hunden. J Periodontol. 2016;87(7):790-795. doi:10.1902/jop.2016.150707
- Bracey DN, Seyler TM, Jinnah AH, Lively MO, Willey JS, Smith TL, et al. A decellularized porcine xenograft-derived bone scaffold for clinical use as a bone graft substitute: a critical evaluation of processing and structure. J Funct Biomater. 2018;9(3):45.https://doi.org/10.3390/jfb9030045
- Renzo et al.: Veränderungen der Gewebedimensionen nach Erhalt des Alveolarkamms mit verschiedenen Xenotransplantaten in Verbindung mit einer Kollagenmembran. Results at the 4-Month Re-Entry Surgery. Int Arch Oral Maxillofac Surg, 2017, 1:003 12.
- Guarnieri R, Di Nardo D, Di Giorgio G, Miccoli G, Testarelli L. Effectiveness of Xenograft and Porcine-Derived Resorbable Membrane in Augmentation of Posterior Extraction Sockets with a Severe Wall Defect. Eine röntgenologische/tomographische Auswertung. J Oral Maxillofac Res. 2019 Mar 31;10(1):e3. doi: 10.5037/jomr.2019.10103. PMID: 31086644; PMCID: PMC6498814
- Pirnazar P. et al. "Bakteriostatische Wirkung von Hyaluronsäure". Zeitschrift für Parodontologie 1999;70:370-374
- Eliezer M, Sculean A, Miron RJ, et al. 'Hyaluronic acid slows down collagen membrane degradation in uncontrolled diabetic rats.' J Periodontal Res. 2019;00:1-9. https ://doi.org/10.1111/jre.12665
- Longaker T et al. 'Studies in Fetal Wound Healing: V. Eine verlängerte Anwesenheit von Hyaluronsäure charakterisiert die fötale Wundheilung. Ann. Surg. 1991; April:292-296.
- Mast BA et al. 'Hyaluronic Acid Modulates Proliferation, Collagen and Protein Synthesis of Cultured Fetal Fibroblast'. Matrix,1993;13:441–446.
- Asparuhova MB et al. 'Activity of two hyaluronan preparations on primary human oral fi broblasts.' J Periodont Res.2018;00:1-13.
- Salbach J et al. "Regeneratives Potenzial von Glykosaminoglykanen für Haut und Knochen". J Mol Med 2012;90:625-635.