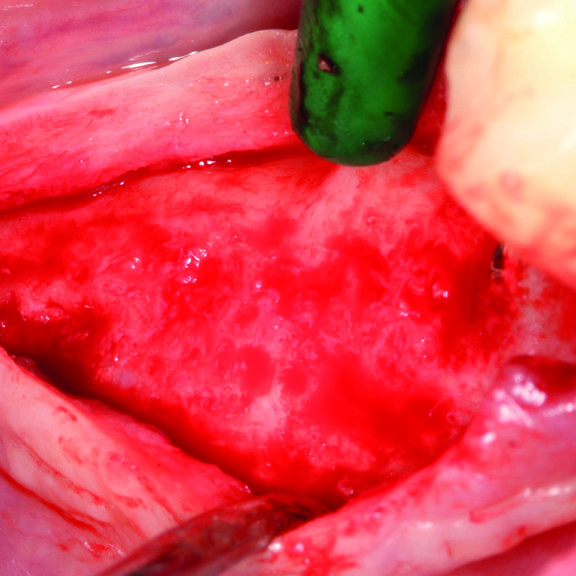
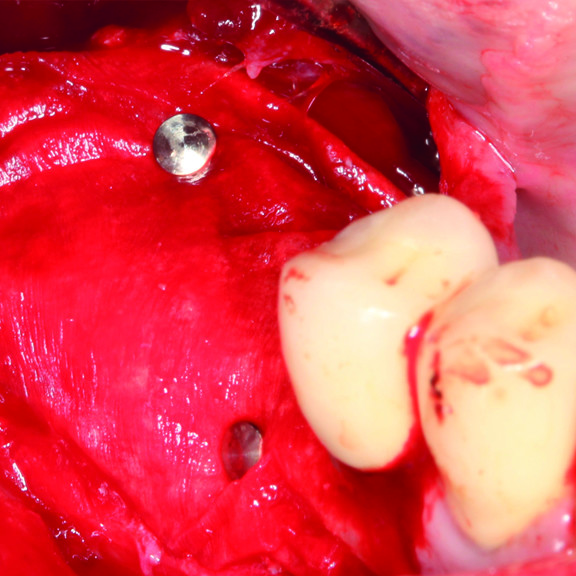
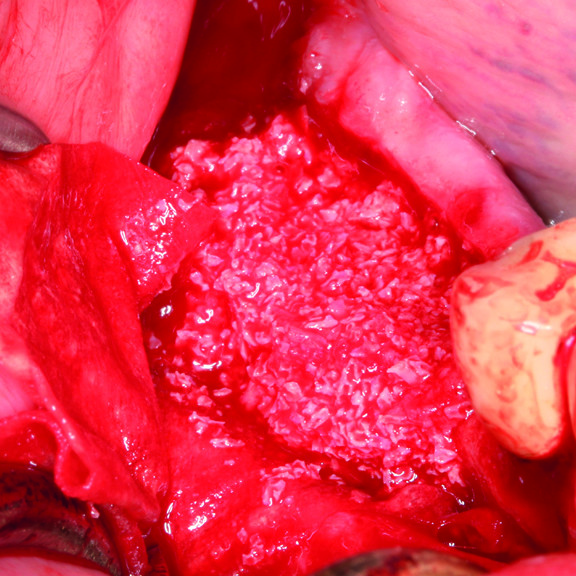
Régénération des tissus durs
FAVORISER LA RÉGÉNÉRATION
Chez REGEDENT, nous nous attachons à tirer parti de la régénération des tissus durs en faisant remplacer les échafaudages artificiels par des cellules osseuses autogènes, tout en assurant un volume osseux stable et en minimisant le nombre d'interventions chirurgicales. En fin de compte, les patients bénéficient d'une meilleure prévisibilité du traitement, associée à des résultats performants à long terme.
QU'EST-CE QUE LA RÉGÉNÉRATION DES TISSUS DURS ?
La perte de tissu dur/os est une caractéristique importante de la dentisterie. En parodontologie, par exemple, les agents pathogènes, les facteurs génétiques et les problèmes environnementaux, comme le tabac, peuvent entraîner une perte de tissu dur. Cela peut entraîner le déplacement des dents, leur dislocation et, finalement, leur perte [1,2].
En implantologie, l'utilisation d'implants dentaires présente des avantages notables pour les patients. Cependant, elle présente certains risques dus à l'utilisation de matériaux inertes en contact direct avec l'os et à l'absence de ligament parodontal (LPD). Le PDL sert de tampon pour répartir les forces de mastication et, lorsqu'il est absent, il peut entraîner une résorption de l'os de la mâchoire [3,4].
QUATRE TYPES DE RÉGÉNÉRATION DES TISSUS DURS
Diverses techniques sont utilisées pour améliorer le processus d'ostéogenèse, comme la greffe osseuse [5], les échafaudages [6], les cellules souches [7] et les facteurs de croissance. La greffe osseuse permet de combler les lacunes physiques créées par l'os manquant ou endommagé, d'assurer la stabilité structurelle et de stimuler la croissance du tissu osseux [8]. Les greffes osseuses sont divisées en quatre groupes [9, 10]. Tout d'abord, l'os autogène est considéré comme l'"étalon-or" du remplacement osseux [11], car il est utilisé avec un traitement minimal et constitue le matériau de substitution osseuse le plus efficace et le plus rapide à guérir [8]. Les applications cliniques ont montré que l'on obtient un nouvel os et de nouvelles attaches de tissu conjonctif parodontal [12].
Deuxièmement, les banques de tissus fournissent différents types de greffons osseux allogéniques [13]. On sait qu'elles ne sont pas aussi efficaces que les autogreffes en raison des traitements chimiques intensifs nécessaires pour prévenir une éventuelle infectiosité, qui perturbent la structure hiérarchique de l'os et éliminent une quantité importante de facteurs de croissance nécessaires à une régénération osseuse efficace [8].
Troisièmement, les xénogreffes présentent des avantages distincts. Elles sont produites en masse à des coûts de traitement abordables. Cependant, comme elles proviennent de tissus osseux d'autres espèces, leurs caractéristiques ostéologiques natives sont différentes de celles des tissus osseux humains. Pourtant, parmi les xénogreffes, certaines, comme les substituts d'origine porcine, favorisent la régénération osseuse grâce à leurs caractéristiques physico-chimiques et à leur structure semblable à celle de l'os humain [8, 14, 15]. En outre, l'os porcin présente un risque relativement faible de zoonose [16].
Enfin, les matériaux de greffe synthétiques, tels que l'hydroxyapatite, sont utilisés pour leur ostéoconduction, leur dureté et leur acceptabilité par l'os. Certains greffons osseux synthétiques sont constitués de carbonate de calcium, dont l'usage commence à diminuer car il est totalement résorbable en peu de temps et facilite la rupture de l'os. Cette dernière catégorie de matériau de greffe fait de plus en plus l'objet de recherches car elle présente des avantages intéressants que les xénogreffes n'ont pas.
DIX SIGNES D'UNE RÉGÉNÉRATION RÉUSSIE DES TISSUS DURS
- Manipulation conviviale du matériau de greffe et de la membrane pour un protocole de traitement rentable et prévisible.
- Utilisation d'un matériau biocompatible
- Stabilisation rapide des caillots sanguins
- Angiogenèse rapide
- Minimiser le processus inflammatoire (gonflement, inconfort)
- Cicatrisation sans incident
- Densité osseuse prévisible
- Volume stable pour une mise en place prévisible des implants
- Matériau résorbable pour éviter d'autres interventions chirurgicales et pour être remplacé par des cellules autogènes.
- Satisfaction des patients et des cliniciens
NOTRE SOLUTION DE RÉGÉNÉRATION DES TISSUS DURS
Hyadent BG, Smartbrane, et Smartgraft sont conçus pour favoriser la régénération des tissus durs tout en étant encore plus conviviaux ensemble.
En effet, le gel combiné à l'os poreux forme un mastic collant en ~3 minutes, et la résistance à la traction de la membrane maintient bien le site augmenté tout en s'adaptant facilement à la surface de l'os, mais sans coller. [20] L'acide hyaluronique présent dans le site augmenté semble accélérer la formation osseuse grâce à ses propriétés migratoires et prolifératives. [21-24]
LES SYNERGIES ENTRE NOS PRODUITS RÉGÉNÉRATIFS
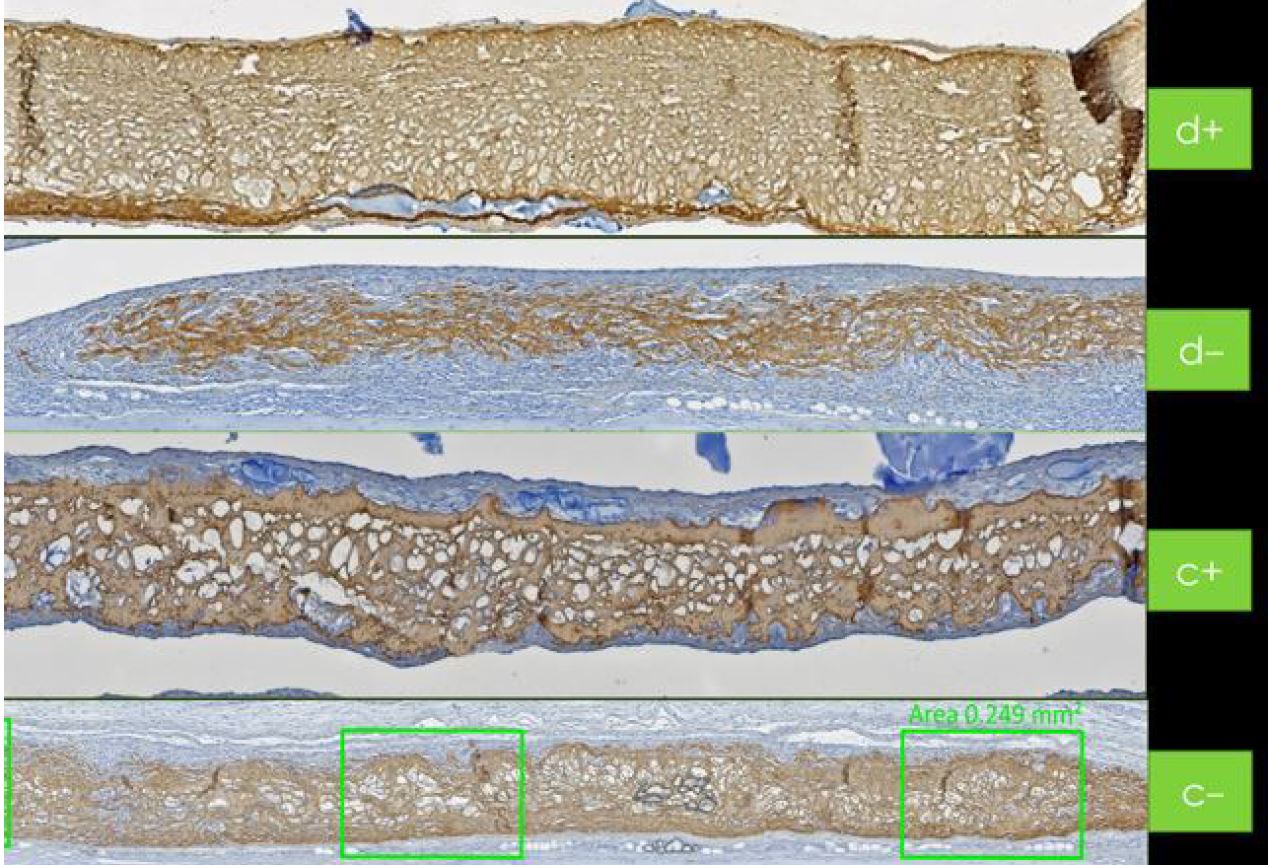
Le portefeuille de Regedent favorise la régénération des tissus durs. Hyadent BG et Smartbrane contribuent à la stabilisation du caillot sanguin [25-26]. L'acide hyaluronique attire les facteurs de croissance naturellement présents dans le sang et favorise la vascularisation en s'appuyant, par exemple, sur des substituts osseux porcins poreux [27-29].
L'adhérence et la prolifération des cellules osseuses sont alors facilitées par les surfaces rugueuses de la membrane porcine et du substitut osseux [26, 28-31]. Dans le même temps, l'acide hyaluronique réticulé à haut poids moléculaire améliore la prolifération cellulaire globale [32-35]. Hyadent BG et Smartgraft contribuent à accélérer la guérison osseuse tout en présentant un remodelage équilibré du volume osseux [26, 36-41].
Pendant le processus de guérison osseuse, l'os collant fabriqué à partir de Hyadent BG et Smartgraft bénéficie de son bouclier bactériostatique naturel [42]. La membrane de collagène solide maintient le site greffé pendant le processus de guérison. Sa fonction de maintien est même prolongée par le ralentissement de la collagénase grâce à l'enduction préalable de la membrane avec Hyadent BG [43].
En reconstruisant non seulement la structure esthétique mais aussi la structure fonctionnelle autour de la dent/implant, Hyadent BG est considéré comme régénérant plutôt que réparant [44-47].
Les propriétés de cicatrisation du portefeuille Regedent sont détaillées dans régénération des tissus mous.
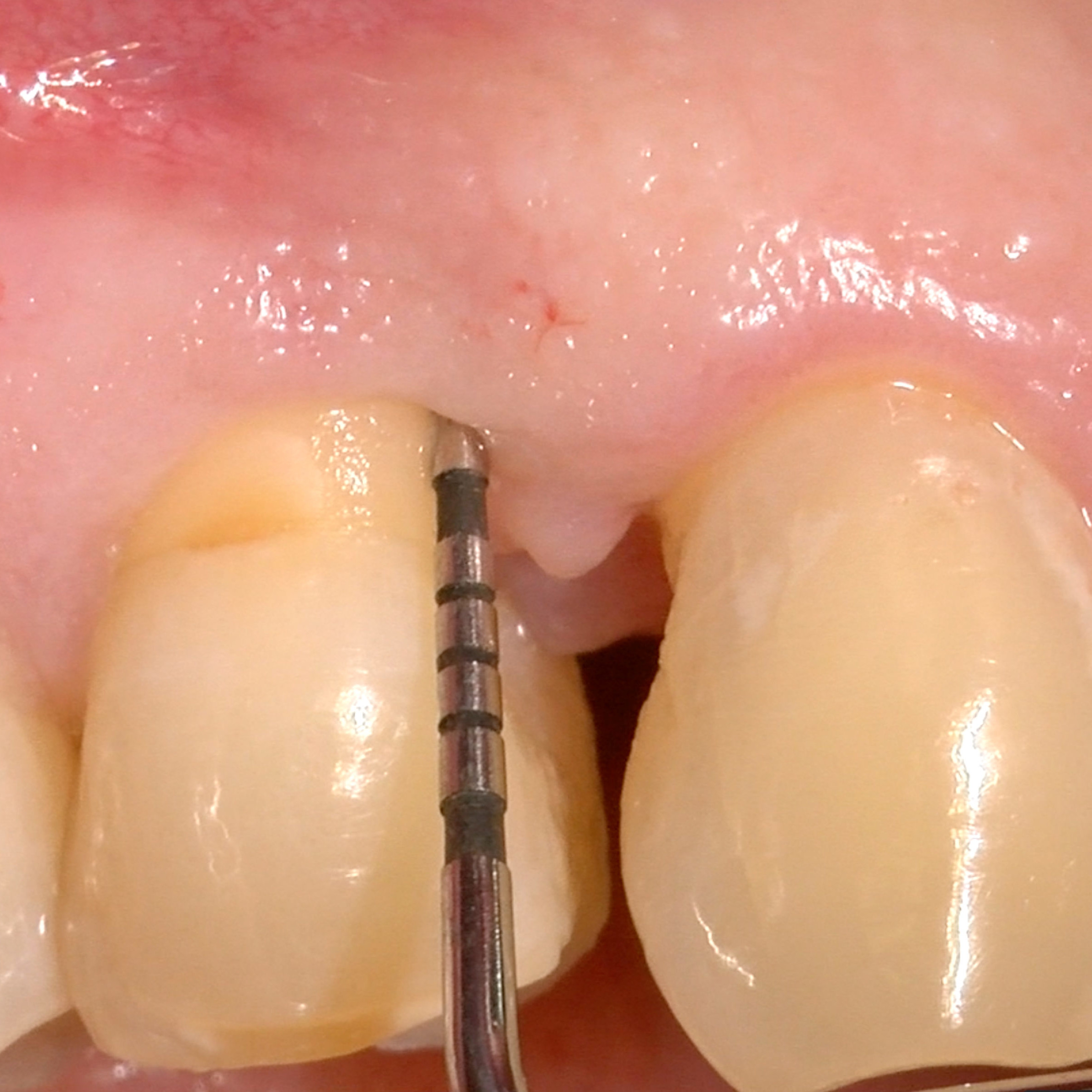
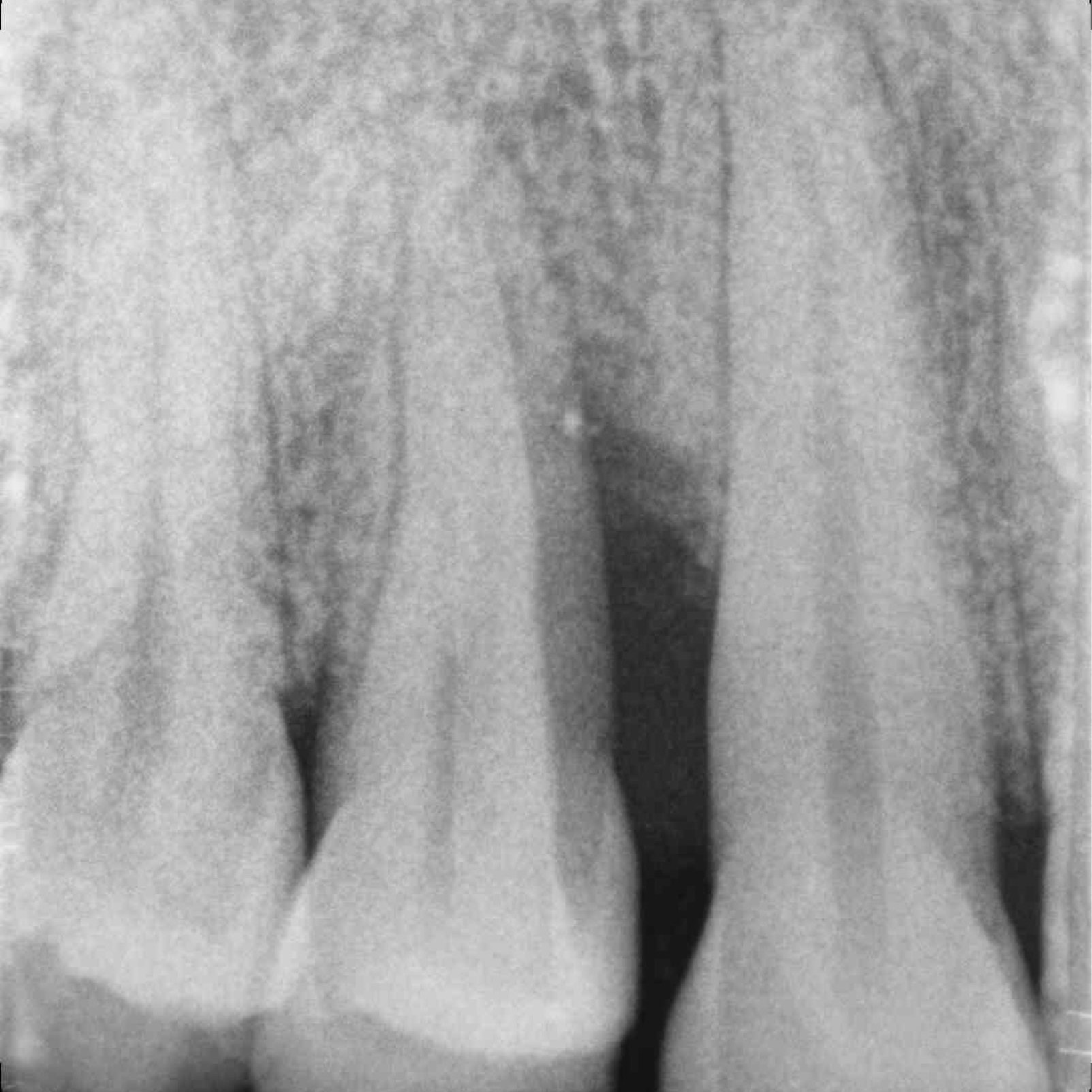
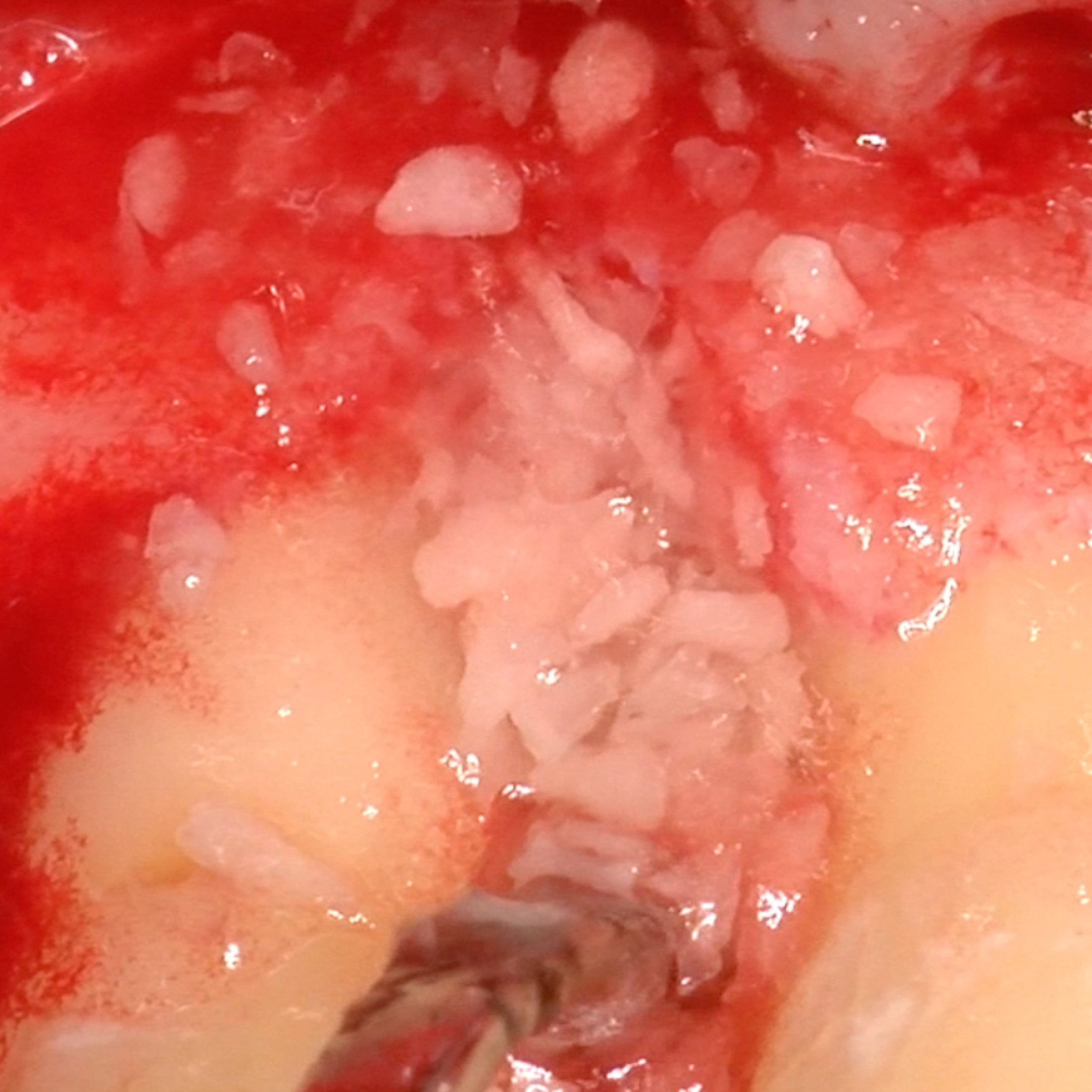
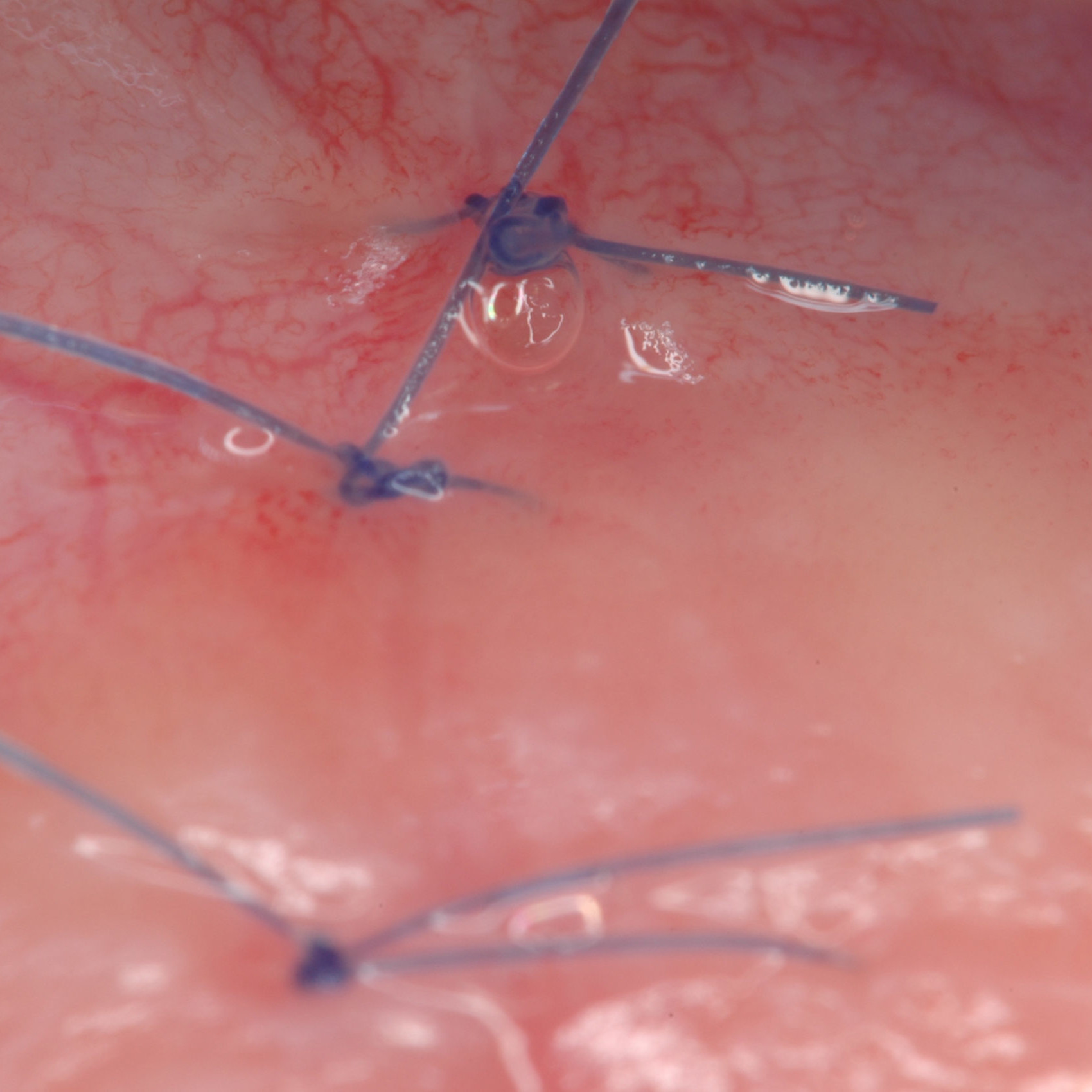
CAS CLINIQUE : RÉGÉNÉRATION DES TISSUS DURS DANS DES DÉFAUTS INTRAOSSEUX
Défaut intra-osseux par le professeur Andrea Pilloni avec régénération des tissus osseux.
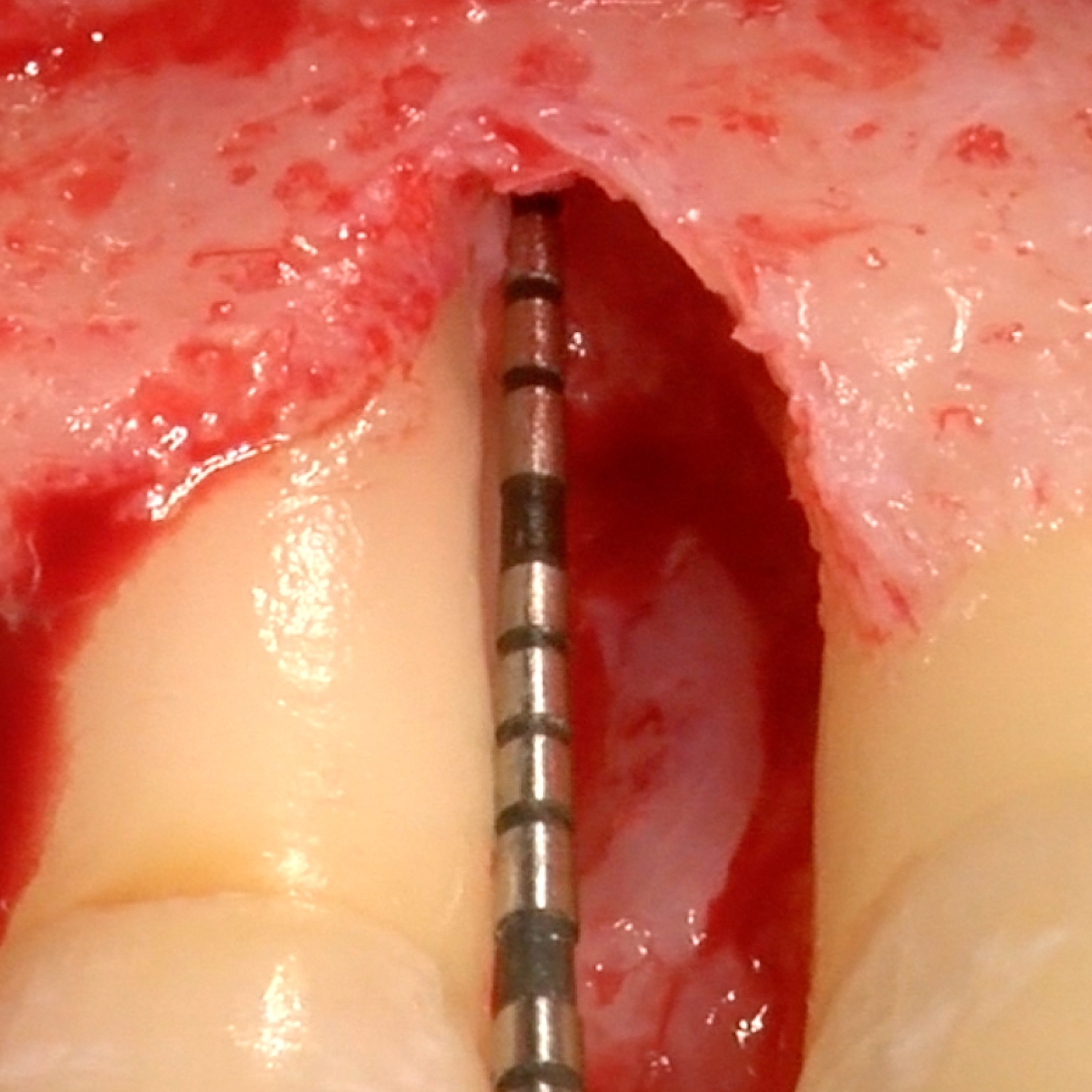
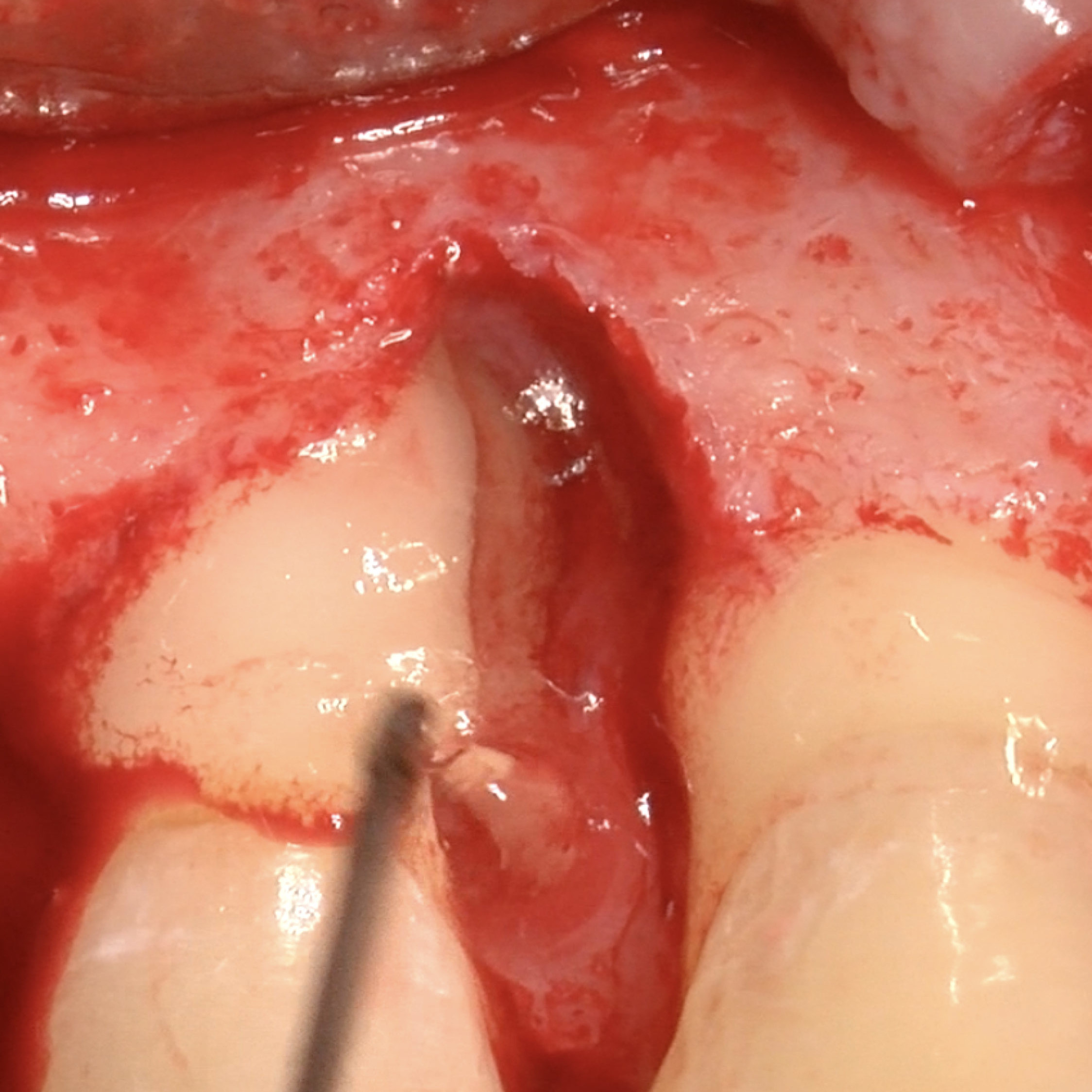
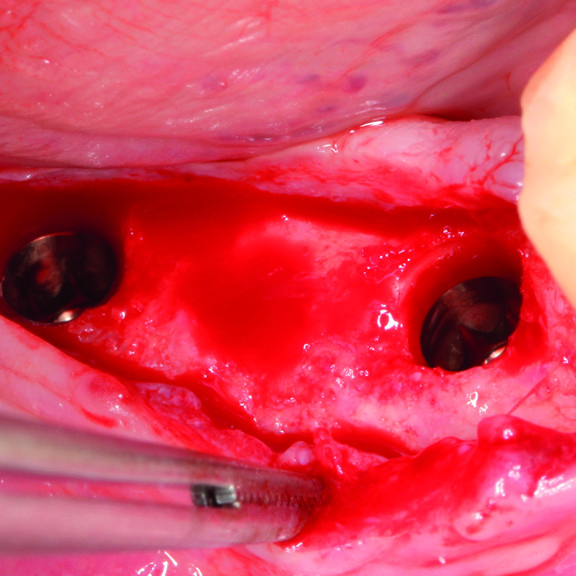
CAS CLINIQUE : RÉGÉNÉRATION DES TISSUS DURS DANS LA ROG AVANT LA POSE D'UN IMPLANT
Augmentation osseuse guidée de la crête édentée distale de la mandibule par le professeur Darko Božić avec régénération des tissus durs.
LITTÉRATURE SCIENTIFIQUE ET ÉTUDES CLINIQUES
- Hernández-Monjaraz B, Santiago-Osorio E, Monroy-García A, Ledesma-Martínez E, Mendoza-Núñez VM. Cellules souches mésenchymateuses d'origine dentaire pour induire la régénération tissulaire dans la parodontite : A Mini-Review. Int J Mol Sci. 2018 Mar 22;19(4):944. doi : 10.3390/ijms19040944. PMID : 29565801 ; PMCID : PMC5979585.
- Pihlstrom BL, Michalowicz BS, Johnson NW. Les maladies parodontales. Lancet. 2005 Nov 19;366(9499):1809-20. doi : 10.1016/S0140-6736(05)67728-8. PMID : 16298220.
- Hasan I, Heinemann F, Bourauel C. The relationship of bone resorption around dental implants to abutment design : a preliminary 1-year clinical study. Int J Prosthodont. 2011;24(5):457-9.
- Maiorana C, Sigurta D, Mirandola A, Garlini G, Santoro F. Résorption osseuse autour d'implants dentaires placés dans des sinus greffés : suivi clinique et radiologique après jusqu'à 4 ans. Int J Oral Maxillofac Implants. 2005;20(2):261-6.
- Anushi, M. ; Suresh, K. Régénération osseuse parodontale dans les défauts intra-osseux à l'aide d'une greffe osseuse ostéoconductrice par rapport à une combinaison de greffe osseuse ostéoconductrice et ostéostimulante : A comparative study. Dent. Res. J. 2015, 12, 25-30.
- Zhou, M. ; Geng, Y.-M. ; Li, S.-Y. ; Yang, X.-B. ; Che, Y.-J. ; Pathak, J.L. ; Wu, G. Nanocrystalline hydroxyapatite-based scaffold adsorbs and gives sustained release of osteoinductive growth factor and facilitates bone regeneration in mice ectopic model. J. Nanomater. 2019, 2019, 10.
- Chen, M. ; Xu, Y. ; Zhang, T. ; Ma, Y. ; Liu, J. ; Yuan, B. ; Chen, X. ; Zhou, P. ; Zhao, X. ; Pang, F. Mesenchymal stem cell sheets : Une nouvelle stratégie cellulaire pour la réparation et la régénération des os. Biotechnol. Lett. 2019, 41, 305-318.
- Lee JH, Yi GS, Lee JW, Kim DJ. Caractérisation physico-chimique du matériau de greffe dérivé de l'os porcin et comparaison avec les xénogreffes bovines pour les applications dentaires. J Periodontal Implant Sci. 2017 Dec;47(6):388-401. https://doi.org/10.5051/jpis.2017.47.6.388
- Ivanovski, S. ; Vaquette, C. ; Gronthos, S. ; Hutmacher, D. ; Bartold, P. Multiphasic scaffolds for periodontal tissue engineering. J. Dent. Res. 2014, 93, 1212-1221,21.
- Park CH, Kim KH, Lee YM, Seol YJ. Stratégies d'ingénierie avancées pour la régénération du complexe parodontal. Matériaux (Bâle). 2016 Jan 18;9(1):57. doi : 10.3390/ma9010057. PMID : 28787856 ; PMCID : PMC5456552.
- Sakkas A, Wilde F, Heufelder M, Winter K, Schramm A. Les greffes osseuses autogènes en implantologie orale sont-elles encore un "étalon-or" ? Une revue consécutive de 279 patients avec 456 procédures cliniques. Int J Implant Dent. 2017 Dec;3(1):23. doi : 10.1186/s40729-017-0084-4. Epub 2017 Jun 1. PMID : 28573552 ; PMCID : PMC5453915.
- Reynolds MA, Aichelmann-Reidy ME, Branch-Mays GL. Régénération des tissus parodontaux : greffes de remplacement osseux. Dent Clin North Am. 2010 Jan;54(1):55-71. doi : 10.1016/j.cden.2009.09.003. PMID : 20103472.
- Keith, J.D., Jr. ; Petrungaro, P. ; Leonetti, J.A. ; Elwell, C.W., Jr. ; Zeren, K.J. ; Caputo, C. ; Nikitakis, N.G. ; Schöpf, C. ; Warner, M.M. Évaluation clinique et histologique d'une allogreffe de bloc minéralisé : Résultats de la période de développement (2001-2004). Int. J. Periodont. Restor. Dent. 2006, 26, 320-327.
- Hölzer A, Pietschmann MF, Rösl C, Hentschel M, Betz O, Matsuura M, Jansson V, Müller PE. L'interrelation des paramètres microstructurels trabéculaires du grand tubercule mesurés pour différentes espèces. J Orthop Res. 2012 Mar;30(3):429-34. doi : 10.1002/jor.21525. Epub 2011 Aug 10. PMID : 21834128.
- Lorenzen E, Follmann F, Jungersen G, Agerholm JS. Un examen de l'appareil génital féminin humain vs porcin et du système immunitaire associé dans la perspective de l'utilisation de miniporcs comme modèle d'infection génitale humaine à Chlamydia. Vet Res. 2015 Sep 28;46:116. doi : 10.1186/s13567-015-0241-9. PMID : 26411309 ; PMCID : PMC4586017.
- Salamanca E, Lee WF, Lin CY, Huang HM, Lin CT, Feng SW, et al. Un nouveau greffon porcin pour la régénération des défauts osseux. Materials (Basel) 2015;8:2523-36.
- Salamanca E, Lee WF, Lin CY, Huang HM, Lin CT, Feng SW, et al. Un nouveau greffon porcin pour la régénération des défauts osseux. Materials (Basel) 2015;8:2523-36.
- Ramírez-Fernández M, Calvo-Guirado JL, Delgado-Ruiz RA, Maté-Sánchez Del Val JE, Vicente-Ortega V, Meseguer-Olmos L. Bone response to hydroxyapatites with open porosity of animal origin (porcine [OsteoBiol mp3] and bovine [Endobon]) : a radiological and histomorphometric study. Clin Oral Implants Res. 2011 Jul;22(7):767-773. doi : 10.1111/j.1600-0501.2010.02058.x. Epub 2011 Jan 18. Rétraction dans : Clin Oral Implants Res. 2018 Jun;29(6):666. PMID : 21244497.
- Go A, Kim SE, Shim KM, Lee SM, Choi SH, Son JS, Kang SS. Effet ostéogénique des particules d'os porcin chauffées à basse température dans un modèle de défaut calvarial de rat. J Biomed Mater Res A. 2014 Oct;102(10):3609-17. doi : 10.1002/jbm.a.35022. Epub 2013 Nov 18. PMID : 24248774.].
- Résultats des tests internes, données dans le dossier.
- Stiller M. et al. 'Performance des granulés et du mastic de phosphate β-tricalcique, matériaux de greffe osseuse après augmentation bilatérale du plancher sinusien chez l'homme' Biomatériaux 2014;35(10):3154-3163.
- Mendes RM et al. "Le hyaluronate de sodium accélère le processus de guérison dans les alvéoles dentaires du rat" Arch Oral Biol 2008 ; 53:1155-1162.
- Asparuhova M, Kiryak D, Eliezer M, Mihov D, Sculean A. 'Activité de deux préparations de hyaluronane sur les fibroblastes oraux humains primaires'. J Periodontal Res 2018 Sep 27. Epub 2018 Sep 27
- Elkarargy A. Préservation des alvéoles à l'aide d'hydroxyapatite / phosphate bêta tricalcique avec acide hyaluronique (étude histomorphométrique). J Am Sci 2013 ; 9(1) : 556-563]. (ISSN : 1545-1003). http://www.jofamericanscience.org. 78
- King SR, Hickerson WL, Proctor KG. Beneficial actions of exogenous hyaluronic acid on healing. Chirurgie 1991;109(1):76-84
- Brett D. Examen des pansements au collagène et à base de collagène. Plaies 2008;20(12).
- King, S.R., Hickerson, W.L. et Proctor, K.G. (1991) Beneficial Actions of Exogenous Hyaluronic Acid on Wound Healing. Surgery, 109, 76-86.
- Deligianni DD, Katsala ND, Koutsoukos PG, Missirlis YF, Effect of Surface Roughness of Hydroxyapatite on Human Bone Marrow Cell Adhesion, Proliferation, Differentiation and Detachment Strength. Elsevier Biomaterials 22 (2001) 87-96 2.
- Shu-Thung L et al. (2014) Isolation et caractérisation d'une apatite carbonate poreuse provenant de l'os spongieux porcin. Science, Technologie, Innovation, Aug : 1-13 Brett D. A Review of Collagen and Collagen-based Wound Dressings. Plaies 2008;20(12)
- Nichols A, Burns DC, Christopher R. Studies on the Sterilization of Human Bone and Tendon Muscoskeletal Allograft Tissue Using Supercritical Carbon Dioxide. Journal of Orthopaedics 2009.
- Sawada K, Terada D, Yamaoka T, Kitamura S, Fujisato T. Élimination des cellules avec du dioxyde de carbone supercritique pour un tissu artificiel acellulaire. J Chemical Technol Biotechnol 2008;83(6):943-949.
- Fawzy ES. et al. Application locale de gel d'hyaluronan en conjonction avec la chirurgie parodontale : un essai contrôlé randomisé.Clin Oral Invest 2012;16:1229-1236.
- Briguglio, F. et al. Traitement des défauts parodontaux infraboniaux à l'aide d'un biopolymère résorbable d'acide hyaluronique:Un essai clinique randomisé. Quintessence Int2013;44:231-240
- Kessiena L. Aya et al. "Hyaluronan in wound healing : Redécouverte d'un acteur majeur'. Wound Rep Reg 2014;22:579-593.Dental Journal. (2017) Vol.42:104-11.
- Sasaki T, Watanabe C, Stimulation de l'ostéoinduction dans la guérison des plaies osseuses par l'acide hyaluronique à haut poids moléculaire. Bone. Vol. 16. No.1 Janvier 1995:9-15
- Ghada Bassiouny A. 'Bioinspired Approach for Dental Implant Fuctionalization : Une étude expérimentale évaluant l'effet du hyaluronate comme revêtement bioactif de l'implant.' J Am Sci 2013;9(11):187-192]. (ISSN : 1545-1003). http://www.jofamericanscience.org. 25
- Shamma MM, Ayad SS, El-dibany RM, Nagui DA 'Évaluation de l'effet de l'acide hyaluronique mélangé au phosphate de calcium biphasé sur la cicatrisation osseuse autour des implants dentaires' Alexandria Dental Journal. (2017) Vol.42 Pages:104-11
- Kim JJ, Song HY, Ben Amara H, Kyung-Rim K, Koo KT. L'acide hyaluronique améliore la formation osseuse dans les alvéoles d'extraction présentant une pathologie chronique : A Pilot Study in Dogs. J Periodontol. 2016;87(7):790-795. doi:10.1902/jop.2016.150707
- Bracey DN, Seyler TM, Jinnah AH, Lively MO, Willey JS, Smith TL, et al. A decellularized porcine xenograft-derived bone scaffold for clinical use as a bone graft substitute : a critical evaluation of processing and structure. J Funct Biomater. 2018;9(3):45.https://doi.org/10.3390/jfb9030045
- Renzo et al : Tissue Dimensional Changes Following Alveolar Ridge Preservation with Different Xenografts Associated with a Collagen Membrane. Résultats lors de la chirurgie de réentrée à 4 mois. Int Arch Oral Maxillofac Surg, 2017, 1:003 12.
- Guarnieri R, Di Nardo D, Di Giorgio G, Miccoli G, Testarelli L. Effectiveness of Xenograft and Porcine-Derived Resorbable Membrane in Augmentation of Posterior Extraction Sockets with a Severe Wall Defect. A Radiographic/Tomographic Evaluation. J Oral Maxillofac Res. 2019 Mar 31;10(1):e3. doi : 10.5037/jomr.2019.10103. PMID : 31086644 ; PMCID : PMC6498814.
- Pirnazar P. et al. "Bacteriostatic effects of hyaluronic acid". Journal of Periodontology 1999;70:370-374
- Eliezer M, Sculean A, Miron RJ, et al. 'L'acide hyaluronique ralentit la dégradation de la membrane collagène chez les rats diabétiques non contrôlés.' J Periodontal Res. 2019;00:1-9. https ://doi.org/10.1111/jre.12665
- Longaker T et al. 'Studies in Fetal Wound Healing : V. Une présence prolongée d'acide hyaluronique caractérise la cicatrisation des plaies fœtales'. Ann. Surg. 1991 ; April:292-296.
- Mast BA et al. 'Hyaluronic Acid Modulates Proliferation, Collagen and Protein Synthesis of Cultured Fetal Fibroblast'. Matrix,1993;13:441–446.
- Asparuhova MB et al. 'Activité de deux préparations de hyaluronane sur les fi broblastes oraux humains primaires'. J Periodont Res.2018;00:1-13.
- Salbach J et al. 'Potentiel régénérateur des glycosaminoglycanes pour la peau et les os.' J Mol Med 2012;90:625-635.