Inhalt
- Was ist quervernetzte Hyaluronsäure (xHyA)?
- Was sind die Unterschiede zwischen den für Zahnbehandlungen verwendeten Hyaluronsäuren?
- Why is hyaluronic acid (HyA) relevant in oral wound healing?
- Wie wurde Hyaluronsäure zum Pionier in der Zahnmedizin?
- Warum wird Hyaluronsäure in der Parodontologie eingesetzt?
- Warum wird Hyaluronsäure in der GBR und der Zahnchirurgie verwendet?
- Welche Vorteile bietet die Kombination von nativer und quervernetzter Hyaluronsäure in der Zahnchirurgie?
- Schlussfolgerung: Die Gründe für die Verwendung von quervernetzter Hyaluronsäure bei Zahnbehandlungen
- Literatur
Was ist quervernetzte Hyaluronsäure (xHyA)?
Hyaluronsäure, auch bekannt als Hyaluronan und abgekürzt als HA oder HyA, die für zahnärztliche Behandlungen sowie in anderen medizinischen und kosmetischen Anwendungen verwendet wird, ist ein natürlich vorkommendes, nicht sulfatiertes Glykosaminoglykan. Es wurde erstmals 1934 von Meyer und Palmer aus dem Glaskörper des Auges isoliert.1 Quevernetzte Hyaluronsäure (xHyA) wird durch einen Prozess erzeugt, bei dem neue Bindungen zwischen linearem/nativem HA gebildet werden, wodurch die Moleküle miteinander verbunden werden (Vernetzung); siehe unten für weitere Einzelheiten zu ihren Eigenschaften und Anwendungen.
Physiologische Funktion der Hyaluronsäure
Hyaluronsäure besitzt wichtige hygroskopische, rheologische und viskoelastische Eigenschaften und weist daher zahlreiche physiologische und strukturelle Funktionen auf. Neben ihrer bekannten Rolle als Schmiermittel in den Gelenken spielt sie auch eine wichtige Rolle bei grundlegenden Regenerationsprozessen wie der Wundheilung und der Embryogenese. HA tritt besonders bei schneller Geweberegeneration und -reparatur in Erscheinung.
HA trägt zur Erhaltung der Elastizität und der Gewebefeuchtigkeit der extrazellulären Matrix (ECM) bei. Sie ist im gesamten Körper weit verbreitet, wobei die Haut etwa die Hälfte der gesamten HA-Menge enthält. In parodontalen Geweben findet sich HA in größeren Mengen vor allem in der Gingiva und dem Zahnhalteapparat2,3.
Ihre biologischen Wirkungen hängen eng mit ihrer Form (vollständige Molekülkette oder Fragmente) und ihrem Molekulargewicht zusammen. In ihrer vollständigen Form hat HA sowohl hydrophile als auch hydrophobe Eigenschaften: sie kann Moleküle aus der Umgebung (Wasser, Ionen, Wachstumsfaktoren) aufnehmen oder abgeben. HA mit einem Molekulargewicht zwischen 0,4 und 4 kDa wirkt entzündungsfördernd, während HA mit einem Molekulargewicht zwischen 20 und 200 kDa an wichtigen biologischen Mechanismen wie der Embryogenese und der Wundheilung beteiligt ist. HA mit einem Molekulargewicht über 500 kDa spielt eine antiangiogene Rolle und fungiert eher als Füller.4 In Abwesenheit eines Wund- oder Heilungsphänotyps liegt HA in Form von langen Ketten mit hohem Molekulargewicht vor und trägt zur harmonischen Funktionsweise der extrazellulären Matrix bei. Sie spielt eine strukturelle Rolle, reguliert die Gewebebefeuchtung und -plastizität, steuert die Zell-Zell-Interaktionen und hat entzündungshemmende Eigenschaften. Als wesentlicher Bestandteil der extrazellulären Matrix spielt HA auch eine zentrale Rolle im Wundheilungsprozess.5
Was sind die Unterschiede zwischen den für Zahnbehandlungen verwendeten Hyaluronsäuren?
Hyaluronsäure ist kein einzelnes Molekül, sondern eine Familie von Molekülen mit unterschiedlichen Eigenschaften. Die Unterschiede sind vielfältig und können zu verschiedenen Wirkungen führen. Hier sind einige wichtige Merkmale:
Niedriges Molekulargewicht vs. hohes Molekulargewicht
Die physiologischen Funktionen von HA hängen von ihrem Molekulargewicht (MW) ab, das durch die Länge der HA-Kette bestimmt wird. Hochmolekulare (langkettige) Hyaluronsäure ist durch ihre immunsuppressiven, antiangiogenen und entzündungshemmenden Eigenschaften allgemein an der Modulation der Immunantwort beteiligt.
Niedermolekulare (kurzkettige) HA ist für die Wund- und Gewebeheilung von Bedeutung, da sie angiogene, immunstimulierende und entzündungsfördernde Eigenschaften aufweist..6,7
Reinheit
Der Reinheitsgrad von HA-Produkten kann je nach Verwendungszweck erheblich variieren. Es gibt bemerkenswerte Unterschiede in der Qualität von HA, das entweder für kosmetische oder für chirurgische/pharmazeutische Anwendungen verwendet wird. In der Regel erfüllen die für chirurgische/pharmazeutische Zwecke hergestellten HA die höchsten Standards und bieten die besten Reinheitsgrade.
Native/lineare versus quevernetzte Hyaluronsäure (xHyA)
Die Wahl zwischen nativer und vernetzter Hyaluronsäure hängt von der spezifischen Indikation und der gewünschten Funktion ab. Native HA behält ihre natürliche Form und weist das höchste Regenerationspotenzial auf. Sie wird im Körper innerhalb weniger Stunden bis Tage natürlich abgebaut.
Bei quevernetzter Hyaluronsäure (xHyA) werden zusätzliche chemische Modifikationen vorgenommen, um ihr Abbauverhalten zu verlängern, das mehrere Wochen bis Monate betragen kann. Mit zunehmender Vernetzung der Hyaluronsäure werden jedoch ihre physiologischen Eigenschaften beeinträchtigt, und sie wird stärker inert. Es ist wichtig, bei der Formulierung des geeigneten HA-Typs für Medizinprodukte die spezifischen Anforderungen und die beabsichtigte Anwendung zu berücksichtigen.
Zusammensetzung von Gelen auf Hyaluronsäurebasis
Zusätzlich zu den bereits erwähnten Faktoren können Gele auf HA-Basis, die für bestimmte Indikationen verwendet werden, in Bezug auf mehrere Faktoren variieren:
- Konzentration: Die HA-Konzentration im Gel kann die Viskosität und möglicherweise auch die Wirksamkeit beeinflussen. Größere Konzentrationen führen häufig zu einer höheren Viskosität und können die Leistung des Produkts verbessern.
- Zusammensetzung: HA-Formulierungen können aus einer einzigen HA-Art bestehen, die speziell auf ein bestimmtes Gewebe oder Heilungsmuster abzielt. Alternativ kann es auch Formulierungen geben, die mehrere HA-Typen enthalten, die jeweils auf verschiedene Kategorien von Heilungsmustern oder Geweben abzielen. So könnte es beispielsweise eine Kombination von HA-Formulierungen geben, die spezifisch auf Gingivazellen und nicht auf Knochenzellen wirken.
- Zusätzliche Bestandteile: HA-Formulierungen können zusätzliche Substanzen wie Desinfektionsmittel, Peptide, Polynukleotide, Zucker-Derivate (Mannitol) oder Viskositätsmodifikatoren enthalten. Diese Substanzen können potenziell mit den vorteilhaften Eigenschaften von HA interagieren, z. B. durch Beeinflussung des Resorptionsverhaltens oder Verringerung der regenerativen Wirkung. Es ist wichtig, folgende Aspekte sorgfältig zu erwägen:
- die biologischen Anforderungen der Indikation (für den Knochenaufbau wird z.B. eine lange andauernde Wirkung benötigt, im Gegensatz dazu erstreckt sich die Stimulierung der Wundheilung des Zahnfleisches nur über einige wenige Tage)
- die Formulierung muss auf die Besonderheiten der Anwendung abgestimmt sein (z. B. ein Gel für die direkte Anwendung im Operationsgebiet, eine Kombination von HA mit einem anderen Biomaterial für augmentative Eingriffe oder eine Formulierung für die nicht-chirurgische Anwendung in parodontalen Taschen)
- mögliche Wechselwirkungen mit anderen Biomaterialien, um die gewünschten Ergebnisse zu erzielen (z. B. verlangsamt hochmolekulare quevernetzte Hyaluronsäure den Abbauprozess von Kollagen (d. h. Kollagenmembranen werden in Anwesenheit von HA langsamer resorbiert))
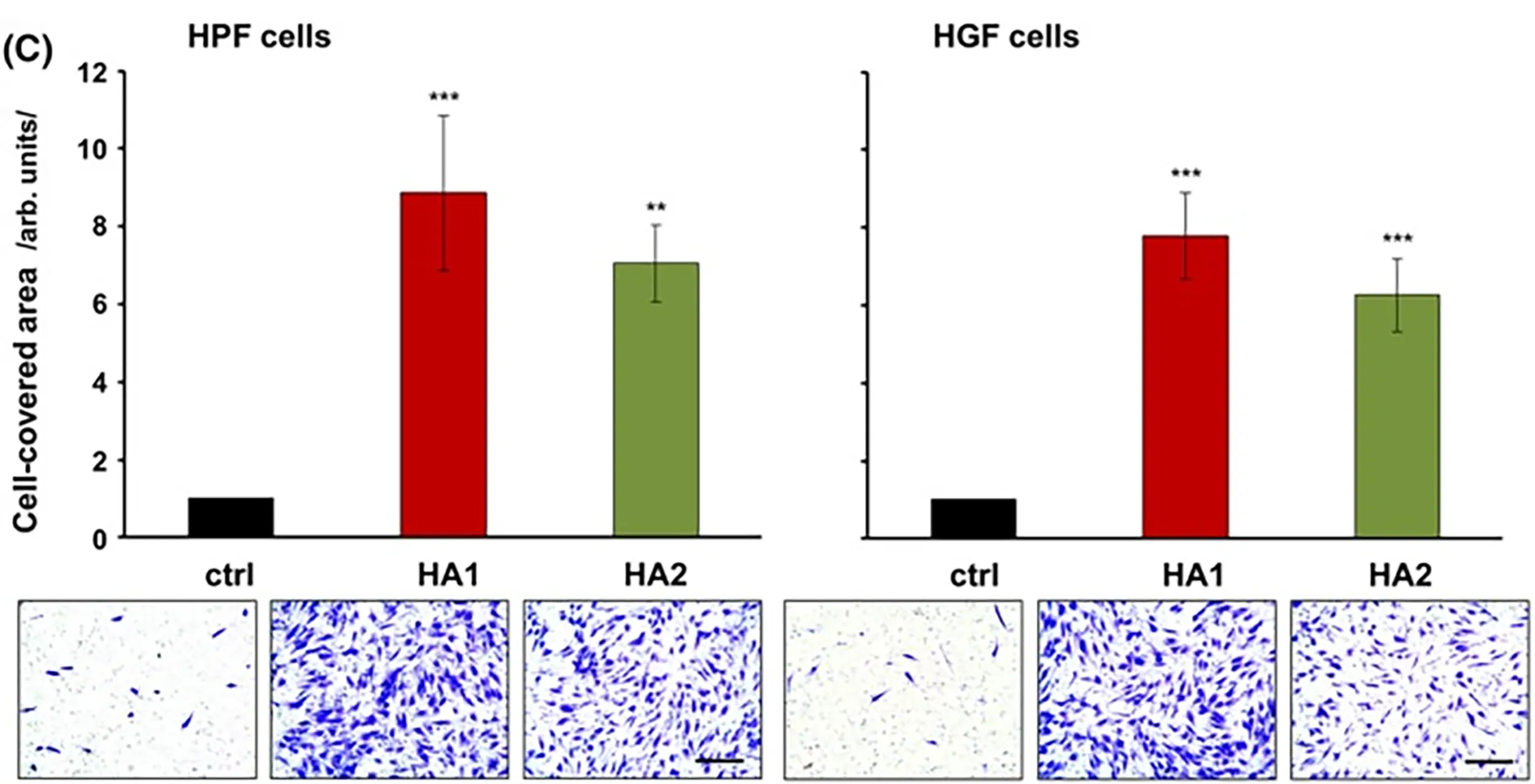
Die folgenden Abbildungen zeigen die Auswirkungen unterschiedlicher Vernetzungsgrade von HA auf die Proliferation von palatalen und gingivalen Zellen.8
Warum ist Hyaluronsäure (HA) für die orale Wundheilung von Bedeutung?
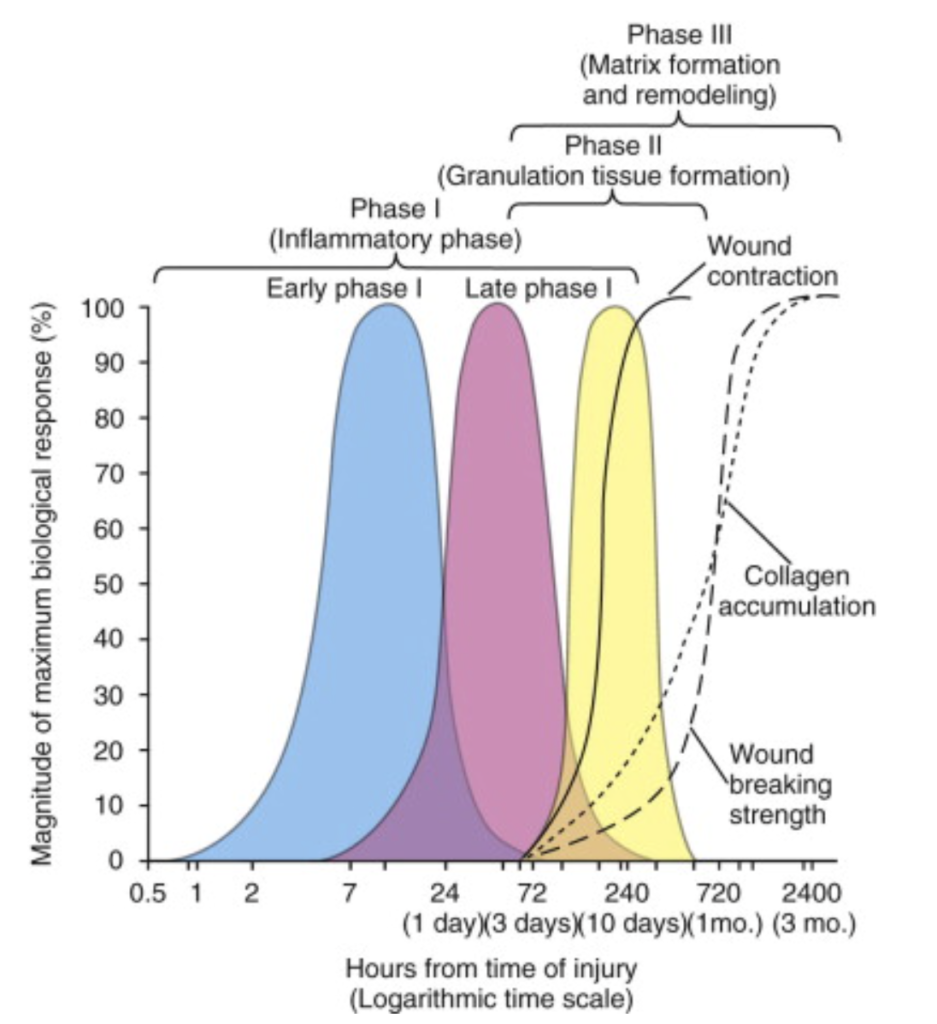
Wenn eine Wunde im Mund entsteht, ist HA eine der ersten Substanzen, die sich in der Wundstelle befindet. Sie unterstützt die ersten Phasen der Wundheilung. HA wird durch spezielle Enzyme (Hyaluronidasen) in kleinere Fragmente zerlegt und weist je nach Molekulargewicht (MW) unterschiedliche Wirkungen auf.9 In der kurzerkettigen Form (Oligomere) bindet sie an verschiedene Rezeptoren und wird zu einem wichtigen Regulator, der an der Gerinnungsbildung, dem Entzündungsprozess, der Angiogenese, der Reparatur und der Gewebereifung beteiligt ist.10
Wie wurde Hyaluronsäure zum Pionier in der Zahnmedizin?
Durch den Einsatz von Hyaluronsäure (HA) konnten in der Zahnmedizin bedeutende Fortschritte erzielt und neue Anwendungen und Techniken entwickelt werden. Aufgrund ihrer vielseitigen Eigenschaften wird Hyaluronsäure in großem Umfang in biomedizinischen Anwendungen eingesetzt, insbesondere in der Dermatologie und der ästhetischen Medizin, z. B. in Form von Verbänden, Pflastern und Injektionen.
Hyaluronsäure für die Zahnpapille?
In der Zahnmedizin konzentrierten sich die ersten Einsatzversuche mit HA auf die Vergrößerung der Interdentalpapille, die gemeinhin als das "schwarzes Dreieck" zwischen den Zähnen bezeichnet wird. Der Erfolg von HA-Injektionen zur Vergrößerung des interdentalen Papillenvolumens hängt von vielen Faktoren ab. Dazu gehören der Schweregrad des Papillenverlustes, die Papillenmorphologie, die Injektionstechnik, die Konzentration und Menge der verwendeten HA sowie patientenbezogene Faktoren wie Rauchen und Mundhygiene.
In mehreren Studien wurde die Wirksamkeit von HA-Injektionen zur Vergrößerung des interdentalen Papillenvolumens untersucht, deren Ergebnisse eine erhebliche Inkonsistenz aufweisen. Neuere Studien,11 zusammen mit einer systematischen Überprüfung12 und einer Meta-Analyse von 12 Studien ergaben eine durchschnittliche Zunahme der Papillenhöhe um 1,25 mm. Die Erfolgsquote reichte von 31,5% bis 100%, und die Dauer der Wirkung lag zwischen 6 und 18 Monaten.
HA-Injektionen zur Vergrößerung der Interdentalpapillen können zwar erfolgreich sein, es sind jedoch auch mögliche Nebenwirkungen zu beachten. So wurden leichte bis mäßige Schmerzen, Schwellungen, Blutergüsse sowie Blutungen an der Injektionsstelle dokumentiert. In seltenen Fällen wurde sogar über schwerwiegendere unerwünschte Ereignisse wie Infektionen, allergische Reaktionen und Gewebsnekrosen berichtet.
Obwohl mehrere Unternehmen diesen Bereich erforscht haben, gibt es derzeit noch kein schlüssiges und vorhersagbares Therapiekonzept für die HA-Injektion in die Interdentalpapille. Weitere Forschungs- und Entwicklungsarbeiten sind erforderlich, um die Techniken zu optimieren und vorhersagbare Behandlungsansätze zu entwickeln.
Hyaluronsäure für die Parodontologie und gesteuerte Knochenregeneration (GBR)
Die Verwendung von Hyaluronsäure in zahnmedizinischen Anwendungen hat dank der umfangreichen Forschungsarbeiten internationaler Forscherteams erheblich an Dynamik gewonnen. Diese Studien haben verschiedene Bereiche der Zahnmedizin erforscht und zu wertvollen Erkenntnissen und Fortschritten geführt. Hier nennen wir einige bemerkenswerte Forschungsteams und ihre Beiträge:13
- Prof. Anton Sculean (Bern, Schweiz) und Prof. Andrea Pilloni (Rom, Italien): Ihre Arbeit konzentriert sich auf die parodontalchirurgische Regeneration und die plastisch-ästhetische Chirurgie. Sie haben zahlreiche präklinische und klinische Studien in diesem Bereich durchgeführt und so zum Verständnis und zur Anwendung von HA in diesen Bereichen beigetragen.
- Prof. Stefan Fickl (Fürth, Deutschland) und Prof. Darko Bozic (Zagreb, Kroatien): Beide forschen mit Ihren Teams auf dem Gebiet der gesteuerten Knochenregeneration (GBR). In ihren Studien haben sie den Gebrauch von HA und deren potenzielle Vorteile bei der Knochenregeneration während verschiedener zahnärztlicher Behandlungen untersucht.
- Prof. Anton Friedmann (Witten-Herdecke, Deutschland) und Prof. Vincenzo Iorio-Siciliano (Neapel, Italien): Beide Teams haben sich auf die nicht-chirurgische Behandlung parodontaler Infektionen sowie auf die chirurgische und nicht-chirurgische Behandlung periimplantärer Infektionen konzentriert. Durch ihre Forschung konnten wertvolle Erkenntnisse bezüglich der Vorteile der Anwendung von HA bei der Behandlung verschiedener parodontaler und periimplantärer Infektionen gewonnen werden.
Warum wird Hyaluronsäure in der Parodontologie eingesetzt?
Die Verwendung von HA in der Parodontologie verspricht, die parodontale Regeneration zu fördern, die Taschentiefe zu verringern, das klinische Attachment zu verbessern und eine praktische Alternative oder Ergänzung zu herkömmlichen Behandlungen zu sein. Weitere Forschungen und klinische Studien werden fortgesetzt, um das volle Potenzial von HA in der Parodontaltherapie zu erforschen.
Regeneratives Potenzial: Durch HA, insbesondere in Kombination mit Knochenersatzmaterialien, können vielversprechende Ergebnisse bei der Regeneration von intraossären parodontalen Läsionen erzielt werden. Präklinische Studien haben gezeigt, dass ein Gel aus vernetzter und nativer HA wesentlich zur Regeneration des Zahnhalteapparats, einschließlich Wurzelzement, parodontalem Ligament und Alveolarknochen, beiträgt. Dieser Ansatz hat sich gegenüber herkömmlichen Methoden mit Kollagenmembranen zur Isolation des Zahnhalteapparat von Epithelzellen als überlegen erwiesen.14,15,16
Vergleichbare Wirksamkeit: Die klinische Wirkung von HA ist mit der von Schmelzmatrix-Derivaten (EMD, Emdogain) vergleichbar. Letztere werden weiterhin als wirksame "Biologics" für die parodontale Regeneration angesehen.17
PD, BOP, CAL Verbesserung: Studien haben gezeigt, dass durch adjuvante Anwendung von HA die Tiefe parodontaler Taschen verringert und das klinische Attachment verbessert werden kann. Dadurch stellt HA eine günstige Alternative bzw. Ergänzung zu herkömmlichen Behandlungsmethoden dar.18,19,
Einfachheit der Anwendung: HA lässt sich in der Chirurgie leicht anwenden, ohne dass eine umfangreiche Vorbereitung der betroffenen Stelle erforderlich ist, sogar in Gegenwart von Blut oder Speichel. Dies macht sie zu einer praktischen Option im Vergleich zu anderen Biologics, wie z. B. Schmelzmatrixderivaten, die bei parodontalen Eingriffen verwendet werden.
Ausweitung auf die mukogingivale Chirurgie: HA wird zunehmend in der Mukogingivalchirurgie eingesetzt, entweder alleine oder als Ergänzung zu Bindegewebstransplantaten und freien Schleimhauttransplantaten. Ähnlich wie die Schmelzmatrixderivate in der Vergangenheit kann HA zur Stabilisierung des Gerinnsels und zur Förderung der Gewebsintegration zwischen der Wurzeloberfläche und dem Lappen bzw. dem Bindegewebstransplantat eingesetzt werden.20
Warum wird Hyaluronsäure in der GBR und der Zahnchirurgie verwendet?
Hyaluronsäure wird in der gesteuerten Knochenregeneration (GBR) angewendet sowie in der Zahnchirurgie, da sie positive Auswirkungen auf die Transplantatstabilisierung und Stabilität des Transplantatvolumens während des Umbaus, die neuen Knochenzellen und den Heilungsprozess hat. Hier erfahren Sie, warum HA in diesen Zusammenhängen verwendet wird:
- Auswirkungen auf Knochenzellen: Erste Erkenntnisse in der Parodontologie, insbesondere aus dem Forschungsteam von Prof. Anton Sculean, haben gezeigt, dass quevernetzte Hyaluronsäure (xHyA) einen positiven Einfluss auf Zellen wie parodontale Ligamente, Zement und Alveolarknochen hat. Es wurde beobachtet, dass die Verabreichung von HA die Proliferation von mesenchymalen Zellen anregt, Wachstumsfaktoren anzieht und die Angiogenese fördert.22,23,24 Dies hat zu einer weiteren Erforschung ihrer Auswirkungen auf Knochenzellen und der Kombination von HA mit Knochenersatzmaterialien geführt.
- Kombination mit Knochenersatzmaterialien: In der klinischen Praxis wurde u.a. die Kombination von xHyA mit Knochenersatzmaterialien wie deproteinisiertem bovinen Knochenmineral (DBBM) untersucht.21 Um den schnellen Zerfall von schnell resorbierbarem natürlichem HA zu überwinden, wurde quevernetzte Hyaluronsäure (xHyA) mit einem langsameren Abbauprofil eingeführt, die eine längere Präsenz und Wirkung ermöglicht, insbesondere bei biologischen Prozessen wie der Knochenheilung.25
- Verbesserte Knochenregeneration: Studien, einschließlich einer Split-Mouth-Fallserie von Dr. Husseini, haben gezeigt, dass die Kombination von vernetzter Hyaluronsäure (xHya) mit DBBM als langsam resorbierendem Knochentransplantatmaterial zu einer signifikant geringeren volumetrischen Resorption des bukkalen Knochenprofils führte als die Verwendung von DBBM allein. Dies deutet darauf hin, dass durch die Zugabe von xHyA der Bedarf an zusätzlichem Knochentransplantat verringert wurde. Histologische Auswertungen haben außerdem eine höhere Knochenneubildung und eine bessere Knochenqualität in der mit quevernetzter Hyaluronsäure behandelten Gruppe im Vergleich zu der nur mit DBBM behandelten Gruppe gezeigt. In-vitro-Studien lieferten eine biologische Grundlage für diese Ergebnisse und unterstrichen die stimulierende Rolle der Hyaluronsäure bei der Osteoblastenaktivität.26,27,28,29
Die Verwendung von HA, insbesondere von vernetzter Hyaluronsäure, in der GBR und der Dentalchirurgie soll die Knochenregeneration fördern, die Knochenqualität verbessern und den Heilungsprozess optimieren. Laufende Forschungen und klinische Experimente erkunden weiterhin das volle Potenzial und die Vorteile von HA in diesen Anwendungen.
Quevernetzte Hyaluronsäure für "sticky bone" bei der GBR
 Quevernetzte Hyaluronsäure (xHyA) spielt eine wichtige Rolle beim Erreichen von "klebrigem Knochen" und bei der Unterstützung der Primärstabilität augmentierter Stellen, wenn sie mit Knochentransplantatmaterialien kombiniert wird. Die Stabilität der Wunde ist entscheidend für eine volumenstabile Knochenregeneration und hängt von der Fähigkeit der Knochentransplantatpartikel ab, während des Heilungsprozesses an Ort und Stelle zu bleiben. Studien haben gezeigt, dass ein frühzeitiger Wundverschluss eine Verschiebung des Knochenersatzmaterials verursachen kann, was zu einem teilweisen Kollaps des augmentierten Volumens im koronalen Teil der Empfängerstelle führt.30 Durch die Delokalisation der Knochenersatzmaterialpartikel und dem daraus folgenden Volumenverlust des Augmentats wird die Wirksamkeit der gesteuerten Knochenregeneration (GBR) beeinträchtigt.
Quevernetzte Hyaluronsäure (xHyA) spielt eine wichtige Rolle beim Erreichen von "klebrigem Knochen" und bei der Unterstützung der Primärstabilität augmentierter Stellen, wenn sie mit Knochentransplantatmaterialien kombiniert wird. Die Stabilität der Wunde ist entscheidend für eine volumenstabile Knochenregeneration und hängt von der Fähigkeit der Knochentransplantatpartikel ab, während des Heilungsprozesses an Ort und Stelle zu bleiben. Studien haben gezeigt, dass ein frühzeitiger Wundverschluss eine Verschiebung des Knochenersatzmaterials verursachen kann, was zu einem teilweisen Kollaps des augmentierten Volumens im koronalen Teil der Empfängerstelle führt.30 Durch die Delokalisation der Knochenersatzmaterialpartikel und dem daraus folgenden Volumenverlust des Augmentats wird die Wirksamkeit der gesteuerten Knochenregeneration (GBR) beeinträchtigt.
Zur Gewährleistung der Stabilität des Augmentats ist es wichtig, Knochenersatzmaterialien mit geeigneter Partikelgröße und -form zu verwenden, das Augmentat während des Eingriffs ordnungsgemäß zu platzieren und mit einer Barrieremembran zu stabilisieren. Die Zugabe des vernetzten Hyaluronsäure-Gels mit einer verlängerten Resorptionszeit von mehreren Wochen trägt auf verschiedene Weisen dazu bei. Das Gel wirkt als flüssiger Abstandshalter zwischen den Knochenpartikeln, füllt den Hohlraum und verringert so den Kollaps des Augmentats im Vergleich zur Verwendung loser, nur mit physiologischer Kochsalzlösung hydratisierter Knochenpartikel. Als hydrophiles Material zieht quevernetzte Hyaluronsäure Blut an, stabilisiert das Koagel und hilft, die Partikel an Ort und Stelle zu halten. Außerdem interagiert sie mit den entsprechenden Knochenzellen und zieht diese an, wodurch eine schnellere und bessere knöcherne Integration der Knochenersatzmaterialpartikel in das umgebende Knochengewebe gefördert wird.
Welche Vorteile bietet die Kombination von nativer und quervernetzter Hyaluronsäure in der Zahnchirurgie?
Die Kombination von nativer/linearer Hyaluronsäure mit vernetztem Hyaluronsäure-Gel in einem hochkonzentrierten Gel bietet zahlreiche Vorteile, die in der Zahnchirurgie geschätzt werden. Hier sind die wichtigsten Vorteile in diesem Bereich:
- Längere Verweildauer: Die Vernetzung der Hyaluronsäure bewirkt eine um mehrere Wochen längere Präsenz in der Mundhöhle. Diese Zeitspanne kann entscheidend für die Wirkung auf die verschiedenen Zelltypen im Mund sein, die am Heilungsprozess beteiligt sind.
- Hydrophile Eigenschaft: Die hydrophile Beschaffenheit der vernetzten Hyaluronsäure (xHya) zieht Blut an und trägt zur Stabilisierung des Blutgerinnsels bei, wenn sie topisch auf chirurgische Stellen aufgetragen wird. Dies fördert ein günstiges Umfeld für die Heilung.
- Verbesserte Zellanhaftung: Quervernetzte Hyaluronsäure schafft eine ideale Oberflächentopographie, die eine verbesserte Zellanhaftung ermöglicht und so die Gewebeintegration und -regeneration fördert.31
- Geringere Entzündung: xHyA hemmt nachweislich den Entzündungsprozess, was zu einer geringeren Schwellung, weniger Schmerzen und einer schnelleren Epithelisierung der Wunde führt. Diese Wirkungen tragen zu einer Verbesserung des Patientenkomforts und der Genesung bei. 32,33
- Parodontale Regeneration: xHyA-Gel zeigt signifikante regenerative Eigenschaften bei verschiedenen parodontalen Defekten, einschließlich Gingivarezessionen, 34infraalveolären Defekten 35und Furkationen.36 Sie fördert die Regeneration von parodontalem Ligament, Zement und Alveolarknochen.
- Erweiterte Barrierewirkung: In Verbindung mit einer Kollagenmembran verlangsamt die quevernetzte Hyaluronsäure (xHya) die Resorption und verlängert die Barrierewirkung. Dies ist besonders vorteilhaft für Patienten mit hohem Kollagenasestoffwechsel, wie z. B. Diabetiker.37
- Gerüst und Volumenerhalt: Das xHyA-Gel fungiert als biokompatibles flüssiges Gerüst, das sich im Laufe der Zeit allmählich auflöst.38 Es dient als Platzhalter oder in Verbindung mit anderen Biomaterialien (z. B. Knochentransplantatpartikeln), füllt die Lücke zwischen den Biomaterialpartikeln, zieht das Blutgerinnsel an und stabilisiert es, während es gleichzeitig die Migration, Adhärenz und Proliferation von Zellen unterstützt.39 Diese Eigenschaft trägt zur Begrenzung der Volumenresorption bei, was insbesondere in der Implantologie von Bedeutung ist.40,41,42
- Bakteriostatikum und Taschenbehandlung: Bei der Injektion in parodontale und periimplantäre Taschen wirkt das quevernetzte Hyaluronsäure-Gel wie ein bakteriostatisches Schutzschild,43 und hilft, die bakterielle Besiedlung zu reduzieren. Darüber hinaus trägt sie zu einer signifikanten Verringerung der Taschensondierungstiefe (PPD) bei.44
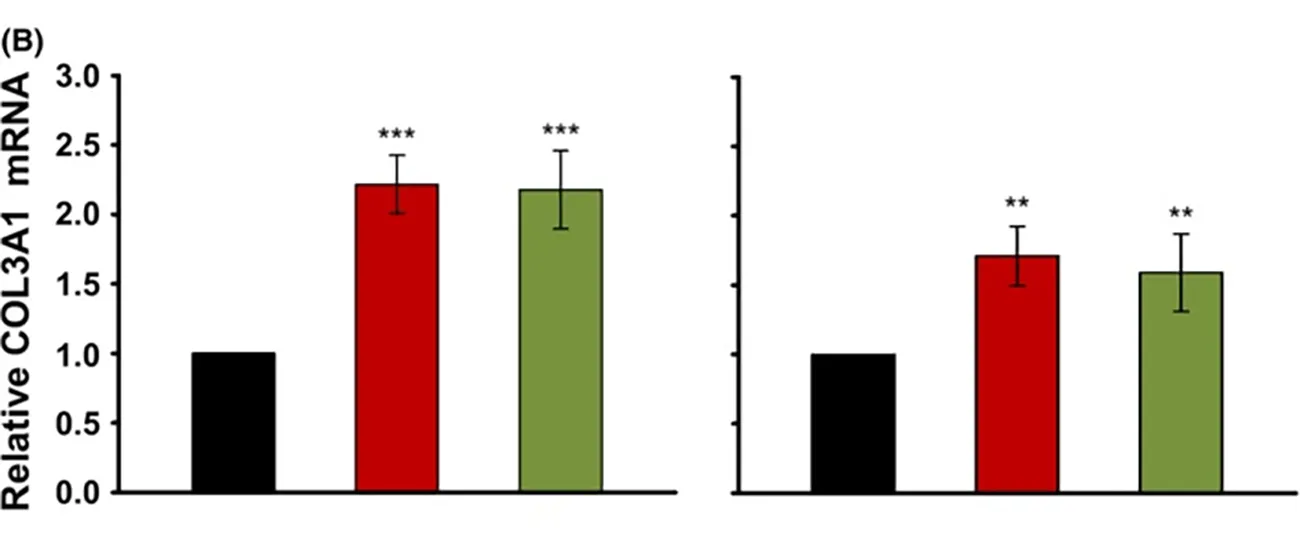
- Narbenlose Wundheilung: Hyaluronsäure mit hohem Molekulargewicht, ob nativ oder leicht vernetzt, induziert eine höhere Expression von Kollagen III (Signale COL3A1, TGF-β3), was mit einer narbenlosen Wundheilung verbunden ist.45 Dieser Effekt wird z.B. bei der fötalen Wundheilung beobachtet und kann zu ästhetisch besseren Heilungsergebnissen beitragen.
Schlussfolgerung: Gründe für die Verwendung von vernetztem Hyaluronsäure-Gel bei Zahnbehandlungen
Zusammenfassend lässt sich sagen, dass die Verwendung eines nativen/vernetzten Hyaluronsäure-Gels bei zahnärztlichen Behandlungen Vorteile bietet wie verlängerte Präsenz, hydrophile Eigenschaften, verbesserte Zellanhaftung, reduzierte Entzündung, parodontale Regeneration, verlängerte Barrierewirkung (z. B. bei Kollagenmembranen), Gerüstfunktionalität, verbesserte Knochenregeneration, bakteriostatische Eigenschaften und narbenlose Wundheilung. Auf diese Weise kann ohne Änderung des individuellen Behandlungsprotokolls ein verbessertes Patientenergebnis erzielt werden.
Literatur
1. Meyer K, Palmer JW. Das Polysaccharid des Glaskörpers. Zeitschrift für Biologische Chemie. 1934;107(3):629-34.
2. Bartold PM, Page RC. Hyaluronsäure, die von Fibroblasten aus normalen und chronisch entzündeten menschlichen Gingivae kultiviert wird. Collagen and Related Research. 1986;6(4):365-78.
3. Dahiya P, Kamal R. Hyaluronic Acid: A Boon in Periodontal Therapy. N Am J Med Sci. 2013;5(5):309-15.
4. Stern R, Asari AA, Sugahara KN. HAluronan-Fragmente: Ein informationsreiches System. Europäische Zeitschrift für Zellbiologie. 2006;85(8):699-715
5. Husseini B, Friedmann A, Wak R, Ghosn N, Khoury G, El Ghoul T, Abboud CK, Younes R. Clinical and radiographic assessment of cross-linked hyaluronic acid addition in demineralized bovine bone based alveolar ridge preservation: Eine randomisierte Split-Mouth-Pilotstudie am Menschen. J Stomatol Oral Maxillofac Surg. 2023 Feb 16;124(4):101426. doi: 10.1016/j.jormas.2023.101426. Epub ahead of print. PMID: 36801259.
6. Kessiena L et al. 'Hyaluronan in wound healing: Rediscovering a major player.' Wound Rep Reg 2014;22:579-593.
7. Deed R et al. 'Early response gene signalling is induced by angiogenic oligosaccharides of hyaluronan in endothelial cells. Inhibition by non-angiogenic, high-molecular-weight hyaluronan.' Int J Cancer, 1997;71:51-56.
8. Asparuhova MB, Kiryak D, Eliezer M, Mihov D, Sculean A. Activity of two HAluronan preparations on primary human oral fibroblasts. J Periodontal Res. 2019 Feb;54(1):33-45. doi: 10.1111/jre.12602. Epub 2018 Sep 27. PMID: 30264516; PMCID: PMC6586051.
9. David-Raoudi M, Tranchepain F, Deschrevel B, et al. Differential effects of HAluronan and its fragments on fibroblasts: relation to wound healing. Wound Repair Regen. 2008;16:274-287.
10. Parodontale Wundheilung/Regeneration von zweiwandigen intraossären Defekten nach rekonstruktiver Chirurgie mit vernetztem Hyalurongel mit oder ohne Kollagenmatrix: eine präklinische Studie an Hunden. Quintessence International. 2021;52(4):308-16.
11. Bertl K, Gotfredsen K, Jensen SS, Bruckmann C, Stavropoulos A. Can hyaluronan injections augmentate deficient papillae at implant-supported crowns in the anterior maxilla? Eine randomisierte kontrollierte klinische Studie mit 6 Monaten Follow-up. Clin Oral Implants Res. 2017 Sep;28(9):1054-1061. doi: 10.1111/clr.12917. Epub 2016 Jul 5. PMID: 27378556.
12. Romano, F., D'Anna, E., Aimetti, M., & Pugliese, M. (2019). Eine systematische Überprüfung und Metaanalyse randomisierter kontrollierter Studien zur Wirksamkeit von Hyaluronsäure bei der Rekonstruktion der Interdentalpapillen. Clinical Oral Investigations, 23(1), 1-10
13. Asparuhova MB, Kiryak D, Eliezer M, Mihov D, Sculean A. Aktivität von zwei HAluronan-Zubereitungen auf primäre menschliche orale Fibroblasten. Journal of Periodontal Research. 2019;54(1):33-45.
14. Shirakata Y, Imafuji T, Nakamura T, Shinohara Y, Iwata M, Setoguchi F, Noguchi K, Sculean A. Crosslinked hyaluronic acid gel with or without a collagen matrix in the treatment of class III furcation defects: Eine histologische und histomorphometrische Studie an Hunden. J Clin Periodontol. 2022 Oct;49(10):1079-1089. doi: 10.1111/jcpe.13694. Epub 2022 Jul 21. PMID: 35817414; PMCID: PMC9796036.
15. Shirakata Y, Imafuji T, Nakamura T, Kawakami Y, Shinohara Y, Noguchi K, Pilloni A, Sculean A. Periodontal wound healing/regeneration of two-wall intrabony defects following reconstructive surgery with crosslinked hyaluronic acid-gel with or without a collagen matrix: a preclinical study in dogs. Quintessence Int. 2021;0(0):308-316. doi: 10.3290/j.qi.b937003. PMID: 33533237.
16. Shirakata Y, Nakamura T, Kawakami Y, Imafuji T, Shinohara Y, Noguchi K, Sculean A. Healing of buccal gingival recessions following treatment with coronally advanced flap alone or combined with a crosslinked hyaluronic acid gel. Eine experimentelle Studie an Hunden. J Clin Periodontol. 2021 Apr;48(4):570-580. doi: 10.1111/jcpe.13433. Epub 2021 Feb 10. PMID: 33513277; PMCID: PMC8248173.
17. Pilloni A, Rojas MA, Marini L, Russo P, Shirakata Y, Sculean A, et al. Heilung intraossärer Defekte nach regenerativer Chirurgie mittels Single-Flap-Ansatz in Verbindung mit Hyaluronsäure oder einem Schmelzmatrix-Derivat: eine randomisierte, kontrollierte klinische Studie über 24 Monate. Clin Oral Investig. 2021;25(8):5095-107.
18. Božić D, Ćatović I, Badovinac A, Musić L, Par M, Sculean A. Treatment of Intrabony Defects with a Combination of Hyaluronic Acid and Deproteinized Porcine Bone Mineral. Materials (Basel). 2021 Nov 11;14(22):6795. doi: 10.3390/ma14226795. PMID: 34832196; PMCID: PMC8624958.
19. Pilloni A, Rojas MA, Marini L, Russo P, Shirakata Y, Sculean A, et al. Heilung intraossärer Defekte nach regenerativer Chirurgie mittels Single-Flap-Ansatz in Verbindung mit Hyaluronsäure oder einem Schmelzmatrix-Derivat: eine randomisierte, kontrollierte klinische Studie über 24 Monate. Clin Oral Investig. 2021;25(8):5095-107.
20. Eliezer M, Imber J, Radakovic S, Pirracchio L, Sculean A. The clinical effect of Hyaluronic acid on root recession coverage: a case series, 6 months evaluation. PD172, Poster Präsentation, EuroPerio. 2018, Amsterdam.
21. Husseini B, Friedmann A, Wak R, Ghosn N, Khoury G, El Ghoul T, Abboud CK, Younes R. Clinical and radiographic assessment of crosslinked hyaluronic acid addition in demineralized bovine bone based alveolar ridge preservation: Eine randomisierte Split-Mouth-Pilotstudie am Menschen. J Stomatol Oral Maxillofac Surg. 2023 Feb 16;124(4):101426. doi: 10.1016/j.jormas.2023.101426. Epub ahead of print. PMID: 36801259.
22. Çankaya ZT, Gürbüz S, Bakirarar B, Kurtiş B. Evaluation of the Effect of Hyaluronic Acid Application on the Vascularization of Free Gingival Graft for Both Donor and Recipient Sites with Laser Doppler Flowmetry: Eine randomisierte, prüfungsverblindete, kontrollierte klinische Studie. Int J Periodontics Restorative Dent. 2020 Mar/Apr;40(2):233-243. doi: 10.11607/prd.4494. PMID: 32032408.
23. Asparuhova MB, Chappuis V, Stähli A, Buser D, Sculean A. Role of HAluronan in regulating self-renewal and osteogenic differentiation of mesenchymal stromal cells and pre-osteoblasts. Clin Oral Investig. 2020 Nov;24(11):3923-3937. doi: 10.1007/s00784-020-03259-8. Epub 2020 Mar 31. PMID: 32236725; PMCID: PMC7544712.
24. Moseley R, Waddington RJ, Embery G. HAluronan and its potential role in periodontal healing. Dent Update. 2002 Apr;29(3):144-8. doi: 10.12968/denu.2002.29.3.144. PMID: 11989392.
25. Bayer IS. Hyaluronsäure und kontrollierte Freisetzung: A Review. Molecules. 2020 Jun 6;25(11):2649. doi: 10.3390/molecules25112649. PMID: 32517278; PMCID: PMC7321085.
26. Husseini B, Friedmann A, Wak R, Ghosn N, Khoury G, El Ghoul T, Abboud CK, Younes R. Clinical and radiographic assessment of cross-linked hyaluronic acid addition in demineralized bovine bone based alveolar ridge preservation: Eine randomisierte Split-Mouth-Pilotstudie am Menschen. J Stomatol Oral Maxillofac Surg. 2023 Feb 16;124(4):101426. doi: 10.1016/j.jormas.2023.101426. Epub ahead of print. PMID: 36801259.
27. Nobis B, Ostermann T, Weiler J, Dittmar T, Friedmann A. Impact of Crosslinked hyaluronic Acid on Osteogenic Differentiation of SAOS-2 Cells in an Air-Lift Model. Materials (Basel). 2022 Sep 20;15(19):6528. doi: 10.3390/ma15196528. PMID: 36233870; PMCID: PMC9572243.
28. Stiller M. et al. 'Performance of β-tricalcium phosphate granules and putty bone grafting materials after bilateral sinus floor augmentation in humans' Biomaterials 2014
29. Alcantara CEP et al 'Hyaluronic acid accelerates bone repair in human dental sockets: a randomized triple-blind clinical trial' Braz Oral Res. 2018.DOI 10.1590/1807-3107bor-2018.vol32.0084
30. Mir-Mari, J, Wui, H, Jung, RE, Hämmerle, CHF, Benic, GI. Einfluss des verblindeten Wundverschlusses auf die Volumenstabilität verschiedener GBR-Materialien: eine in-vitro-kegelstrahlcomputertomographische Untersuchung. Clin. Oral Impl. Res. 27, 2016, 258- 265. doi: 10.1111/clr.12590
31. Mueller A, Fujioka-Kobayashi M, Mueller HD, Lussi A, Sculean A, Schmidlin PR, Miron RJ. 'Effect of Hyaluronic acid on morphological changes to dentin surfaces and subsequent effect on periodontal ligament cell survival, attachment, and spreading' Clinical Oral Investigations 2016 May .DOI 10.1007/s00784-016-1856-6
32. Asparuhova M, Kiryak D, Eliezer M, Mihov D, Sculean A. 'Activity of two HAluronan preparations on primary human oral fibroblasts'.J Periodontal Res 2018 Sep 27. Epub 2018 Sep 27
33. Yıldırım S, Özener HÖ, Doğan B, Kuru B. Effect of topically applied Hyaluronic acid on pain and palatal epithelial wound healing: Eine randomisierte, kontrollierte klinische Studie unter Aufsicht eines Prüfers. J Periodontol. 2018;89(1):36-45. doi:10.1902/jop.2017.170105
34. Shirakata Y, Nakamura T, Kawakami Y, Imafuji T, Shinohara Y, Noguchi K, Sculean A. Healing of buccal gingival recessions following treatment with coronally advanced flap alone or combined with a crosslinked hyaluronic acid gel. Eine experimentelle Studie an Hunden. J Clin Periodontol. 2021 Apr;48(4):570-580. doi: 10.1111/jcpe.13433. Epub 2021 Feb 10. PMID: 33513277; PMCID: PMC8248173.
35. Shirakata Y, Imafuji T, Nakamura T, Kawakami Y, Shinohara Y, Noguchi K, Pilloni A, Sculean. A. Parodontale Wundheilung/Regeneration von zweiwandigen intraossären Defekten nach rekonstruktiver Chirurgie mit vernetztem Hyaluronsäure-Gel mit oder ohne Kollagenmatrix: eine präklinische Studie an Hunden. Quintessence Int. 2021;0(0):308-316. doi: 10.3290/j.qi.b937003. PMID: 33533237.
36. Shirakata Y, Nakamura T, Kawakami Y, Imafuji T, Shinohara Y, Noguchi K, Sculean A. Healing of buccal gingival recessions following treatment with coronally advanced flap alone or combined with a crosslinked hyaluronic acid gel. Eine experimentelle Studie an Hunden. J Clin Periodontol. 2021 Apr;48(4):570-580. doi: 10.1111/jcpe.13433. Epub 2021 Feb 10. PMID: 33513277; PMCID: PMC8248173.
37. Eliezer M, Sculean A, Miron RJ, et al. 'Hyaluronic acid slows down collagen membrane degradation in uncontrolled diabetic rats.'J Periodontal Res. 2019;00:1-9.
https://doi.org/10.1111/jre.12665
38. Eliezer M, Sculean A, Miron RJ, et al. 'Hyaluronic acid slows down collagen membrane degradation in uncontrolled diabetic rats.'J Periodontal Res. 2019;00:1-9.
https://doi.org/10.1111/jre.12665
39. Asparuhova M, Kiryak D, Eliezer M, Mihov D, Sculean A. 'Activity of two HAluronan preparations on primary human oral fibroblasts'.J Periodontal Res 2018 Sep 27. Epub 2018 Sep 27
40. Husseini B, Friedmann A, Wak R, Ghosn N, Khoury G, El Ghoul T, Abboud CK, Younes R. Clinical and radiographic assessment of cross-linked hyaluronic acid addition in demineralized bovine bone based alveolar ridge preservation: Eine randomisierte Split-Mouth-Pilotstudie am Menschen. J Stomatol Oral Maxillofac Surg. 2023 Feb 16;124(4):101426. doi: 10.1016/j.jormas.2023.101426. Epub ahead of print. PMID: 36801259.
41. Mir-Mari J, Wui H, Jung RE, H€ammerle CHF, Benic GI.Einfluss des verblindeten Wundverschlusses auf die Volumenstabilität verschiedener GBR-Materialien: eine in vitro Kegelstrahl-Computertomographie-Untersuchung. Clin. Oral Impl. Res. 00, 2015, 1-8 doi: 10.1111/clr.12590
42. Kauffmann F et al (2023) unveröffentlicht
43. Pirnazar P, Wolinsky L, Nachnani S, Haake S, Pilloni A, Bernard GW. Bakteriostatische Wirkung von Hyaluronsäure. J Periodontol 1999;70:370-4.
44. Eliezer M, Imber JC, Sculean A, Pandis N, Teich S, 'Hyaluronic acid as adjunctive to nonsurgical and surgical periodontal therapy: a systematic review and meta-analysis', Clin O Inv
2019; doi: s00784-019-03012-w
45. Asparuhova MB, Kiryak D, Eliezer M, Mihov D, Sculean A. Activity of two HAluronan preparations on primary human oral fibroblasts. J Periodontal Res. 2019 Feb;54(1):33-45. doi: 10.1111/jre.12602. Epub 2018 Sep 27. PMID: 30264516; PMCID: PMC6586051.